화학식이란 물질을 구성하는 원소와 개수를 원소기호로 나타내는 모든 식(분자식, 실험식, 시성식, 구조식, 이온식)을 말합니다. 화학을 공부하다 보면 비슷비슷해 보이기 때문에 헷갈리게 합니다. 위험물기능사, 위험물산업기사, 위험물기능장 자격증을 취득하기 위해서라면 반드시 이해하고 있어야 할 내용입니다. 화포자(화학포기자)라도 이해할 수 있도록 쉽고 재미있게 안내해 보겠습니다. 준비되셨죠? 출발합니다.

목차
1. 화학식
1) 원소기호 표기방법
2) 화학식 작성 규칙 및 적용 예
3) 화학식의 종류
- 분자식
- 실험식
- 시성식
- 구조식
- 이온식
2. 화학식과 분자식의 차이점
화학식(chemical formula)
1. 화학식(chemical formula)
화학식이란 물질을 구성하는 원소와 갯수를 원소기호로 나타내는 모든 식을 말하는 것으로, 화학식은 화학 물질을 식별하고 특징을 파악하는 데에 매우 중요한 정보를 제공합니다.
① 물질(화합물)을 구성하는 원자의 종류와 수를 나타낸 식입니다.
② 원자의 종류는 원소기호로(즉, 영문자로), 원자의 개수는 아라비아 숫자로 나타냅니다.
③ 원소기호와 아라비아 숫자로 물질을 간단히 나타내는(표시하는) 방법입니다.

2. 원소기호 표기방법

- Ⓐ 질량수 : 양자수 + 중성자수
- Ⓑ 원자번호 : 양성자(양자)의 수
- Ⓒ 이온 전하량 : +, -, 2- , 2+ 등으로 표기
- Ⓓ 원자의 개수 : 2개 이상부터 표기하고 1개일 경우 생략함
★참고 _ 원자번호 1 ~ 20번까지는 무조건 암기해 두세요. 자세한 내용은 아래 링크 참조하세요.

3. 화학식 작성 규칙 및 적용 예
① 그 물질을 만들고 있는 원자의 종류를 원자 기호로 나타냅니다.
② 원자의 수는 그 원자 기호의 오른쪽 하단에 작게 씁니다.
③ 단, 원자 1 개의 경우는 숫자 1 을 생략합니다.

4. 화학식의 종류
분자식은 원소 기호와 숫자를 사용하여 분자를 이루는 원자의 종류와 개수를 나타낸 것으로, 분자식만으로 어떤 원소로 이루어져 있는지 파악하기에 용이합니다. 화학식은 원소 기호와 숫자를 이용하여 물질을 간단하게 나타낸 것으로, 분자로 존재하지 않는 물질도 표현할 수 있으므로 분자식보다 넓은 개념입니다.
① 분자식 : 각 원소별로 개수를 파악해 나열식으로 표현해주는 방식
② 실험식 : 개수가 아닌 개수의 비율을 의미, 최대공약수로 나누어 준다.
③ 시성식 : 작용기로 표시해 주는 식
④ 구조식 : 구조식은 분자의 결합형태까지 자세히 나타내주는 식
⑤ 이온식 : 이온화되었을 때의 전하량을 표시해 주는 것
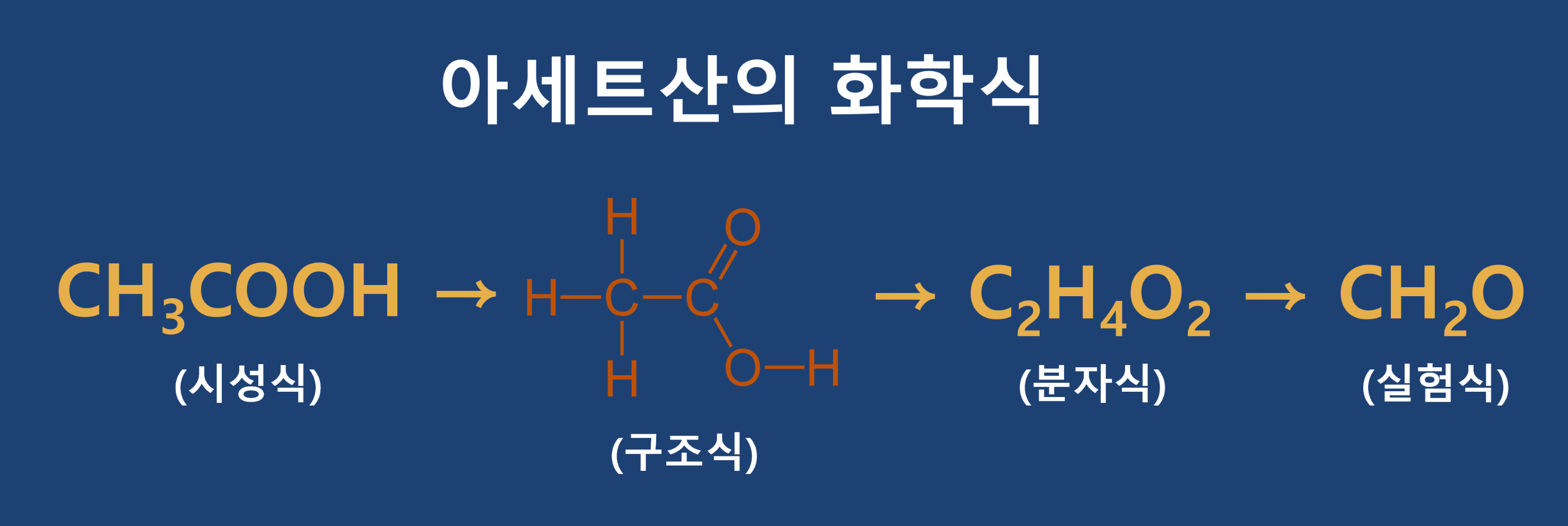
분자식(Molecular Formula)
각 원소별로 개수를 파악해 나열식으로 표현해주는 방식으로 분자를 구성하는 원자의 종류와 수를 나타낸 식입니다. 즉, 각 원소별로 갯수를 파악해 나열식으로 표현해주는 방식으로 물질(화합물)을 구성하는 원자의 종류를 실제적 수로 나타낸 화학식입니다.
수소(
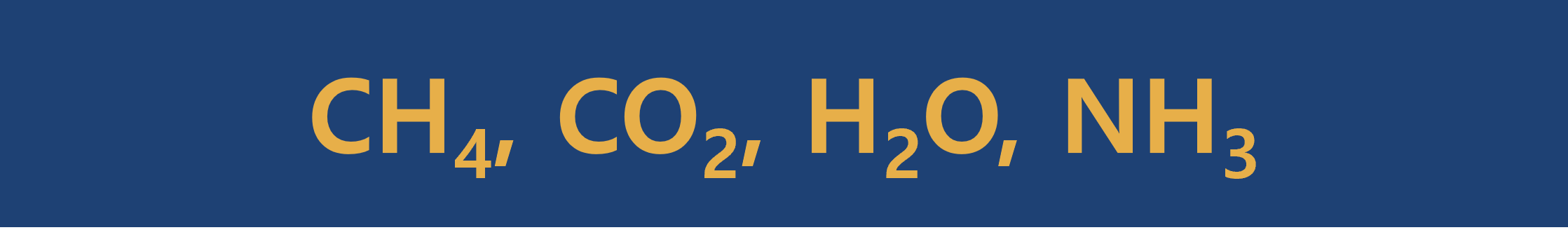
다만
실험식(Empirical Formula)
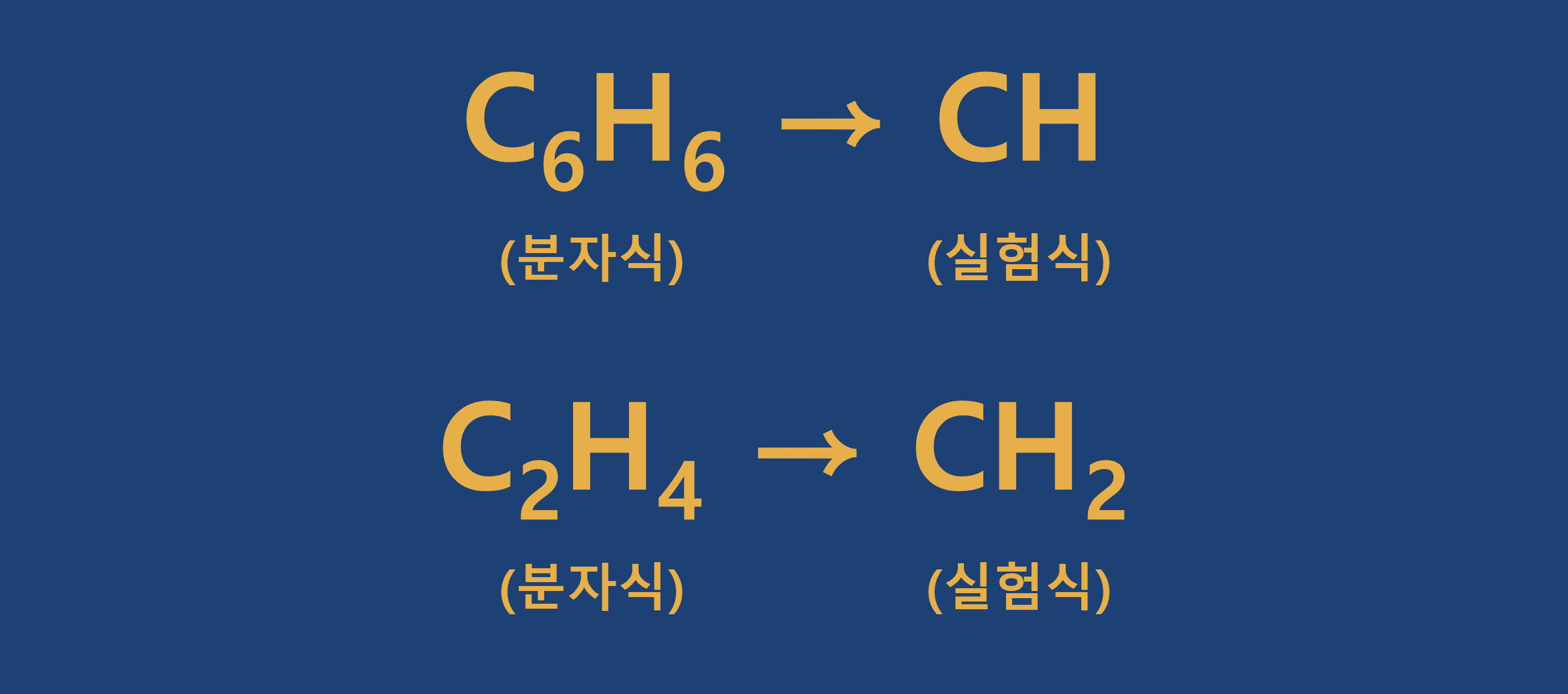
실험식은 이름이 말해주듯이 실험실에서 알아낸 식을 말합니다. 물질을 구성하는 원소의 종류와 원자수를 간단한 정수비로 나타낸 식입니다.
개수가 아닌 개수의 비율을 의미하며, 최대공약수로 나누어 줍니다.
① 물질(화합물)을 구성하는 원자의 종류를 상대적 수(또는 가장 작은 정수 비)로 나타낸 화학식입니다.
② 실험(원소 분석)을 통해 제일 먼저 구하는 식입니다.
이온결합하는 물질은 분자식으로 나타낼 수 없기 때문에 각 물질이 결합하고 있는 개수비만을 표현한 실험식을 사용합니다. 또 실험을 통해 탄소화합물을 구성하는 종류와 결합비를 알아낸 후 사용하는 식이기도 합니다. 참고로 이온결합 물질을 표현할 때는 실험식이라고 하지 않고 편하게 화학식이라고 합니다.
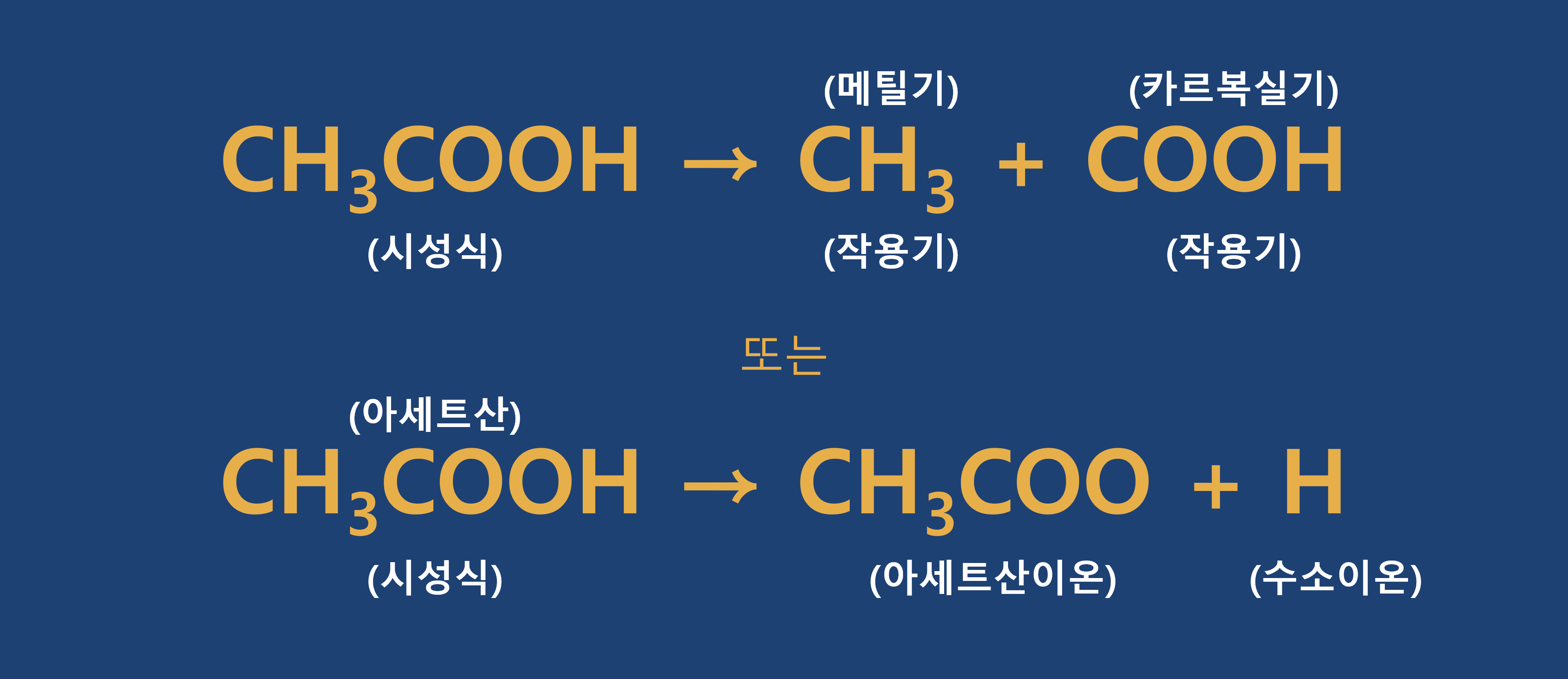
시성식(Rational Formula)
그 분자의 특성을 나타내는 작용기(또는 원자단, Radical)를 이용하여 나타낸 식을 말합니다. 즉, 특정한 성질을 나타내는 작용기를 표현한 식입니다.
알코올은 알코올 성질을 나타내는 히드록시기(-OH)를 표현하고, 카르복실산은 카르복실산의 성질을 나타내는 카르복실기(-COOH)등을 표현하는 식입니다.
★ 참고 _ 작용기
특정한 성질을 보이는 원소들의 집합을 작용기라고 합니다.
예)
- 1가의 원자단
메탄올의 분자식은
즉,
비슷한 작용기를 가지는 화합물들은 공통적인 화학 성질을 공유하므로 작용기를 따로 쓰는 방법으로 화학식을 나타내면 이 물질의 간략한 성질을 쉽게 알 수 있게 됩니다.
분자식으로 표시하면 두 물질의 특성에 관한 정보는 잘 알 수 없지만, 시성식으로 표시하면
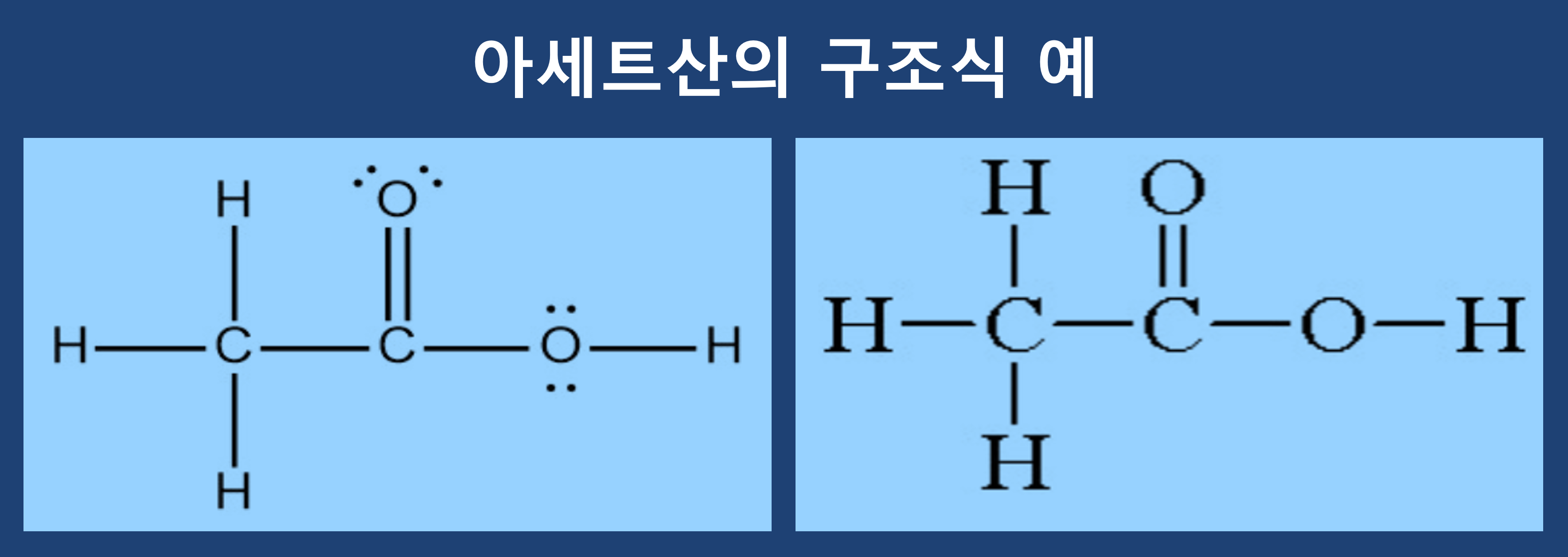
구조식(Structural Formula)
원소와 원소사이에 어떤 결합이 있는지를 결합선을 표현하여 나타내면 구조를 쉽게 이해할 수 있습니다. 즉 구조식은 원자와 원자 사이(공유전자쌍)를 결합선으로 나타낸 식을 말합니다.
① 원자는 원소 기호로, 결합은 선으로 나타낸 화학식입니다.
② 물질(화합물)을 구성하는 원자들의 결합 상태(연결 순서)를 알 수 있습니다.
다만 구조식에서 표현되는 것이 실제 구조가 아니라는 점은 간과해서는 알 될 점입니다. 결합선을 보면서 구조를 예측할 수 있다는 것이 구조식의 가장 큰 특징입니다.
이온식(ion Formula)
이온화되었을 때의 전하량을 표시해 주는 것으로서 원소기호에 전하를 표시한 식을 말합니다. 즉, 이온을 이루는 원자의 종류나 전하를 원소 기호를 이용하여 표현한 화학식입니다.
예1)
예2)
예3)
★ 참고 _ 이온식과 관련된 좀 더 자세한 내용은 아래를 참조하시기 바랍니다.
이온(양이온과 음이온), 이온결합 화합물 명명법(양이온, 음이온)
이온(ionic)은 원자나 분자가 전자를 잃거나 얻어서 전하를 띠게 된 입자입니다. 원자나 분자가 전자를 잃으면 양전하를 띠는 양이온이 되고, 전자를 얻으면 음전하를 띠는 음이온이 됩니다. 이온
digital-normad7.tistory.com
① 전하는 윗첨자로 표시하는데, 양이온을 표현하려면 +를 붙이고 음이온을 표현하려면 -를 붙입니다. 이때, 주의할 점은 전하의 부호를 먼저 쓰지 않는 것입니다. 전자를 n개 잃으면(양이온) n+라고 표기하고, 얻으면(음이온) n-라고 표기하며, n의 값이 1이면 생략합니다.
② 다원자 이온의 경우, 원소 기호의 오른쪽 위에 전체 전하를 표시합니다.
예)
③ 이온 결합한 물질인 경우 두 개의 이온식 사이에 띄어쓰기를 한다(예: Na+ Cl-)
예)
④ 이온화합물 명명법
㉠ 양이온은 '원자 이름' + '이온'으로, 음이온은 '원자 이름' + '화 이온'으로 씁니다.
㉡ 원자 음이온이며 '소'로 끝날 때, '소'를 생략하고 '화 이온'을 붙여서 씁니다.
| 구분 |
원자
|
이온식
|
분자
|
이온식
|
| 양이온 |
수소 이온
|
|
암모늄 이온
|
|
|
칼륨 이온
|
|
옥소늄 이온
|
|
|
|
나트륨 이온
|
|
|||
|
리튬 이온
|
|
|||
|
은 이온
|
|
|||
|
구리 이온
|
|
|||
|
칼슘 이온
|
|
|||
|
바륨 이온
|
|
|||
|
베릴륨 이온
|
|
|||
|
스트론튬 이온
|
|
|||
|
알루미늄 이온
|
|
|||
|
아연 이온
|
|
|||
|
철 이온
|
|
|||
|
마그네슘 이온
|
|
|||
| 음이온 |
수소화 이온
|
|
질산 이온
|
|
|
아이오딘화 이온
|
|
수산화 이온
|
|
|
|
플루오린화 이온
|
|
황산 이온
|
|
|
|
염화 이온
|
|
탄산 이온
|
|
|
|
브로민화 이온
|
|
사이안화 이온
|
|
|
|
황화 이온
|
|
|||
|
비화 이온
|
|
|||
|
인화 이온
|
|
|||
|
산화 이온
|
|
|||
화학식과 분자식의 차이점
화학식과 분자식의 차이점은 모호할 수 있습니다. 예를 들어 물은 화학식도, 분자식도 모두
즉, 화학식은 구성 원자의 종류와 수를 나타낸 식이며, 분자식은 분자를 구성하는 원자의 종류와 수를 나타낸 식입니다. 화학식은 분자식에 포함되지 않지만, 분자식은 화학식에 포함되기 때문입니다.

'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 화학식(분자식)을 만드는 규칙(방법) (1) | 2023.12.03 |
|---|---|
| 화학식(분자식) 연습문제 (0) | 2023.12.02 |
| 물질, 원소(Element), 원자(Atom), 분자(Molecule), 화합물(Compound), 화학식(분자식, 실험식, 구조식) (0) | 2023.12.01 |
| 산화수를 구하는 규칙과 산화수 계산 방법 (0) | 2023.11.30 |
| 산화-환원(redox, 酸化還元), 전자의 이동, 산화수와 산화상태 (0) | 2023.11.29 |



댓글