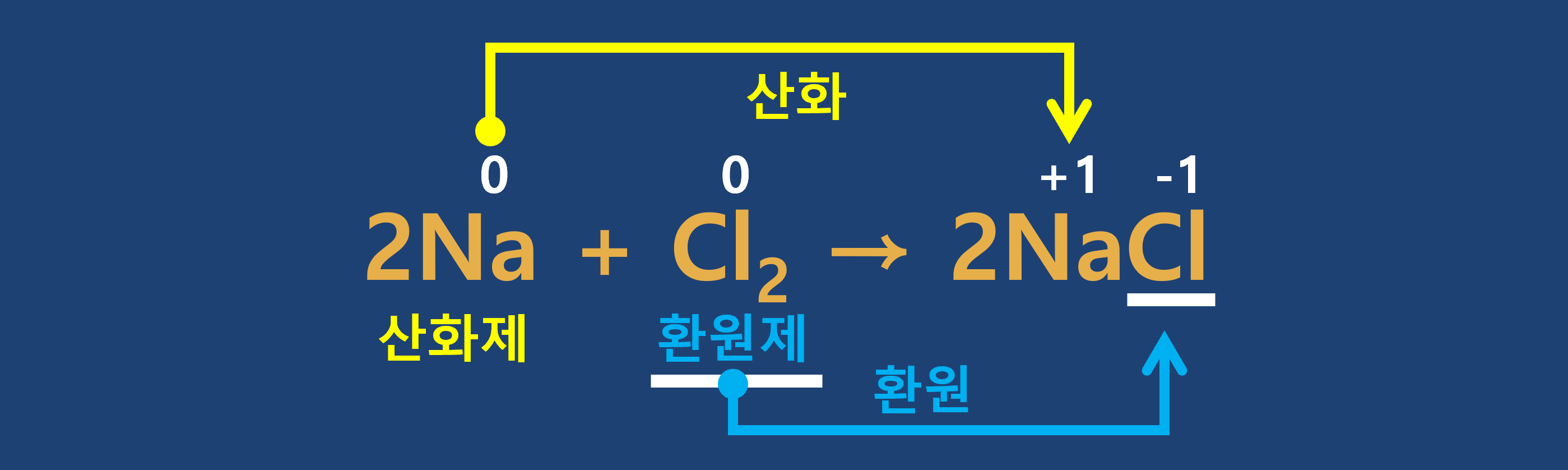
산화-환원 반응은 물질 사이에서 전자를 주고받는 화학반응입니다. 산화는 물질이 전자를 잃어서 산화수가 증가하는 반응이고, 환원은 물질이 전자를 얻어서 산화수가 감소하는 반응입니다. 산화와 환원은 항상 동시에 일어나며, 전자를 잃는 물질을 산화제, 전자를 얻는 물질을 환원제라고 합니다.
산화-환원 반응은 다양한 형태로 나타날 수 있습니다. 예를 들어, 연소 반응은 산소와 결합하는 산화-환원 반응이고, 산과 염기 반응은 이온화된 상태에서 전자의 이동이 일어나는 산화-환원 반응입니다. 산화-환원 반응은 생명에 변화를 가져오는 중요한 역할을 하기도 합니다.

★ 참고 _ 산화수 구하는 규칙과 산화수 계산 방법
산화제와 환원제
산화제는 산화-환원 반응에서 상대를 산화시키는 물질을 말합니다. 반대로 환원제는 상대를 환원시키는 물질을 말합니다. 산화제는 주로 비금속 원소들이 있는데 대체로 전자음성도(친화도)가 큰 물질들이 여기에 속합니다. 예로서 전기음성도가 가장 큰
1. 산화제와 환원제
1) 산화제
산화제는 자신은 환원되고, 다른 물질을 산화시키는 물질입니다.
① 전자를 얻기 쉬운 비금속 원소(
② 산화수가 큰 원자가 들어 있는 화합물 (
2) 환원제
① 환원제는 자신은 산화되고, 다른 물질을 환원시키는 물질입니다.
② 전자를 잃기 쉬운 금속 원소(
③ 산화수가 작은 원자가 들어 있는 화합물 (


2. 산화제와 환원제의 상대적 세기
1) SO2
-

2) SO2
-

산화-환원 반응
산화는 물질이 전자를 잃어서 산화수가 증가하는 반응이고, 환원은 물질이 전자를 얻어서 산화수가 감소하는 반응입니다. 산화와 환원은 항상 동시에 일어나며, 전자를 잃는 물질을 산화제, 전자를 얻는 물질을 환원제라고 합니다.
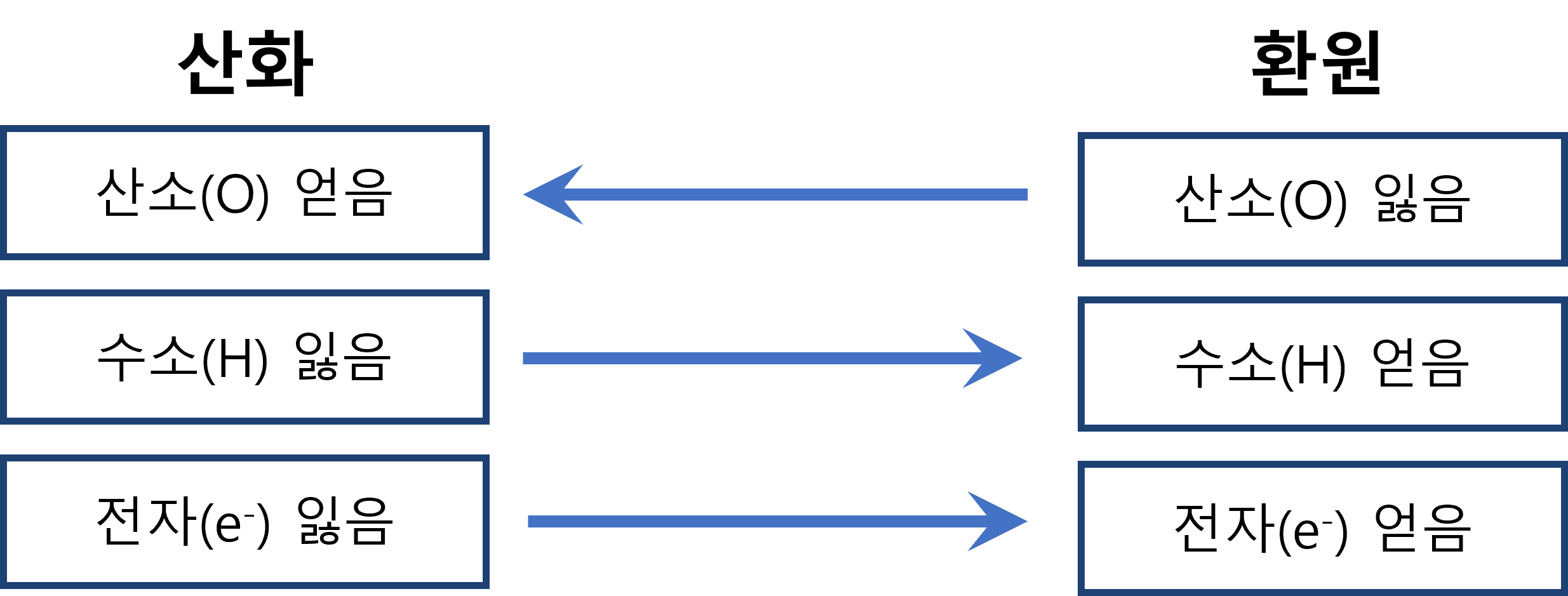
1. 산소의 이동
① 산화 : 어떤 물질이 산소 원자를 얻는 반응
② 환원 : 어떤 물질이 산소 원자를 잃는 반응
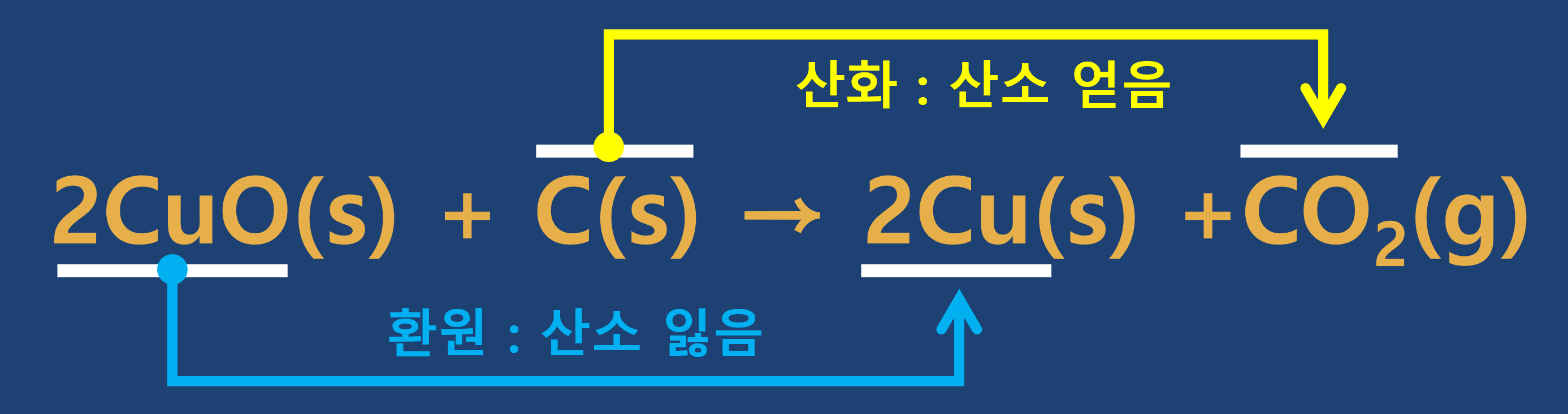
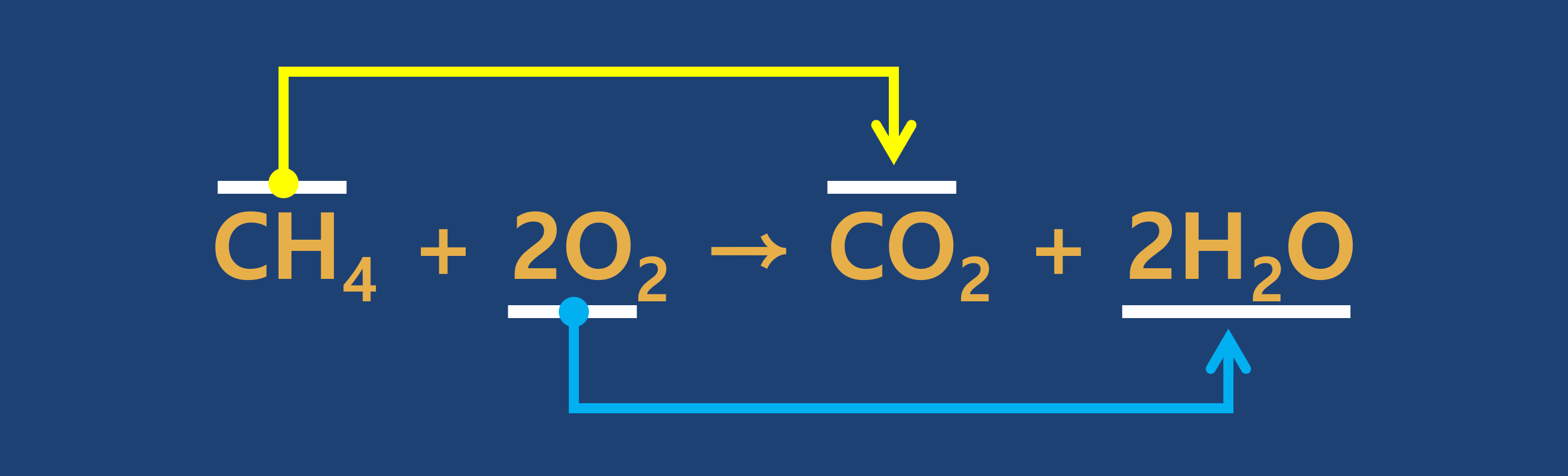
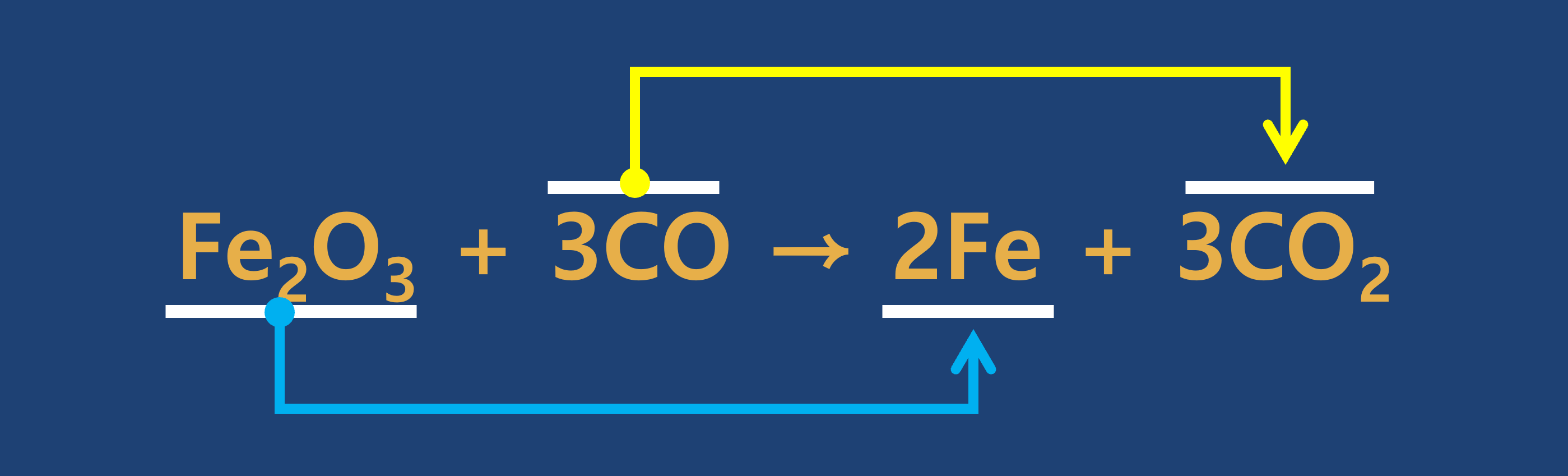
③ 연습문제
- 다음 각 반응에서 반응물은 산화되는가? 또는 환원되는가?
㉠
㉡
㉢
2. 수소의 이동
① 산화 : 어떤 물질이 수소 원자를 잃는 반응
-
② 환원 : 어떤 물질이 수소 원자를 얻는 반응
-
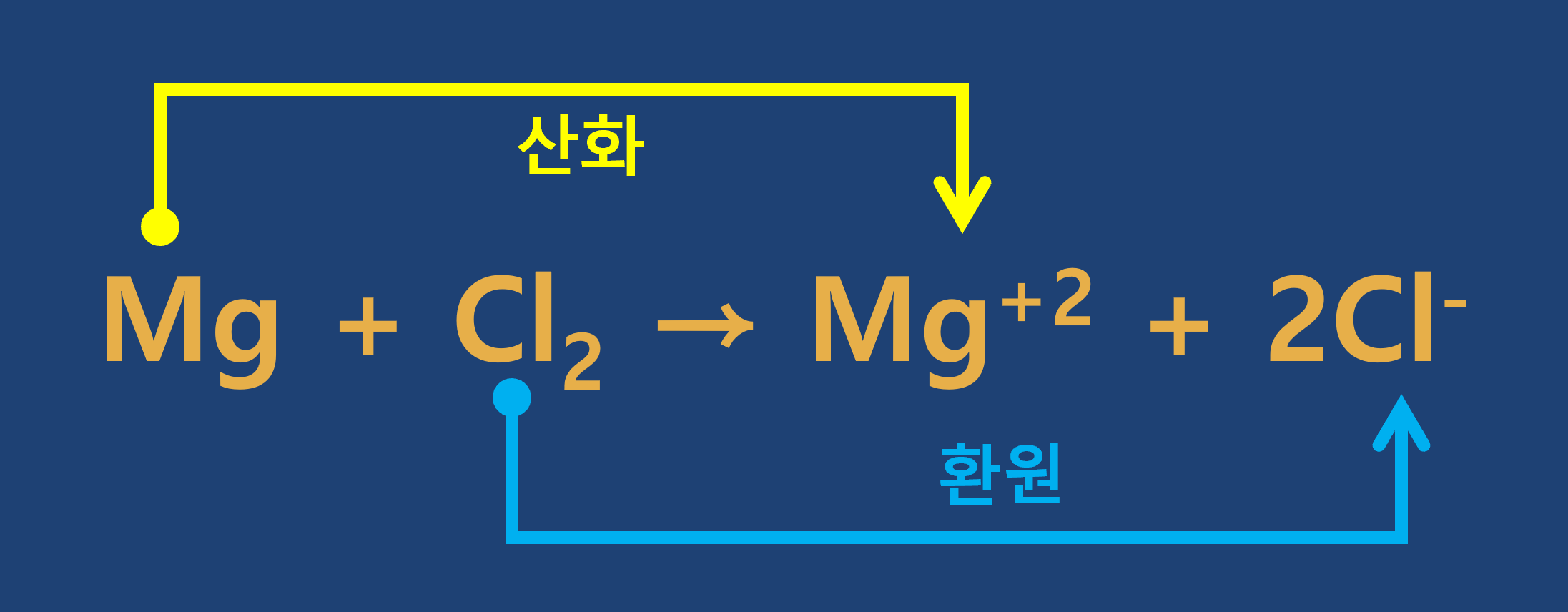
3. 전자의 이동
1) 산화 : 어떤 물질이 전자를 잃는 반응
2) 환원 : 어떤 물질이 전자를 얻는 반응
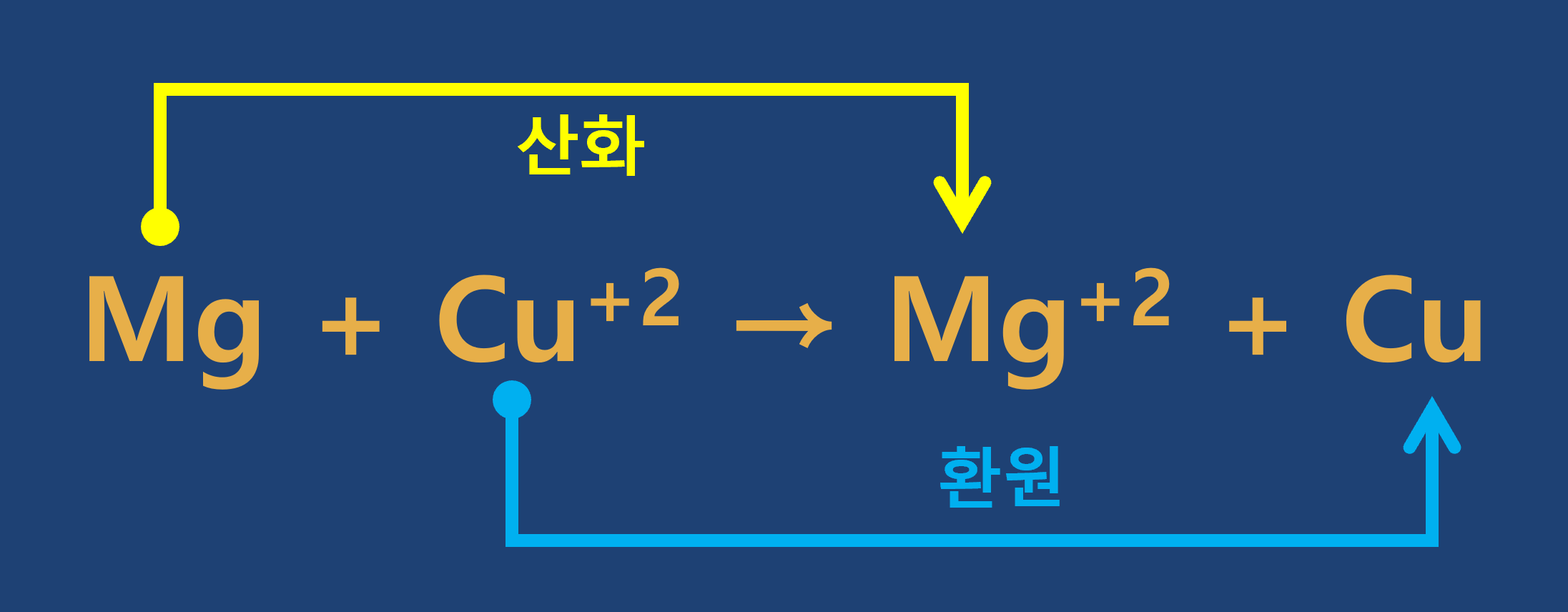
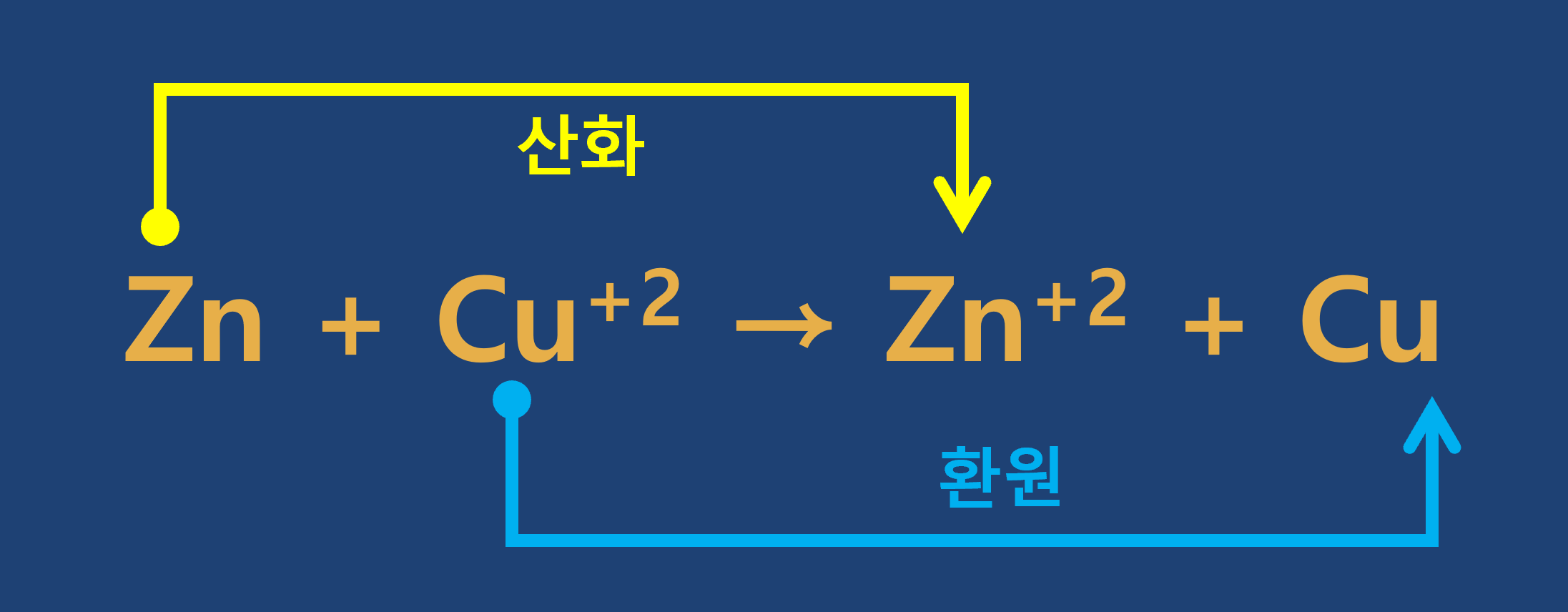
3) 금속과 금속염 수용액 반응에서 전자의 이동
① 아연과 황산구리(Ⅱ) 수용액의 반응
㉠
-
㉡ 용액에 녹아 있던
㉢ 아연과 구리의 산화-환원 반응
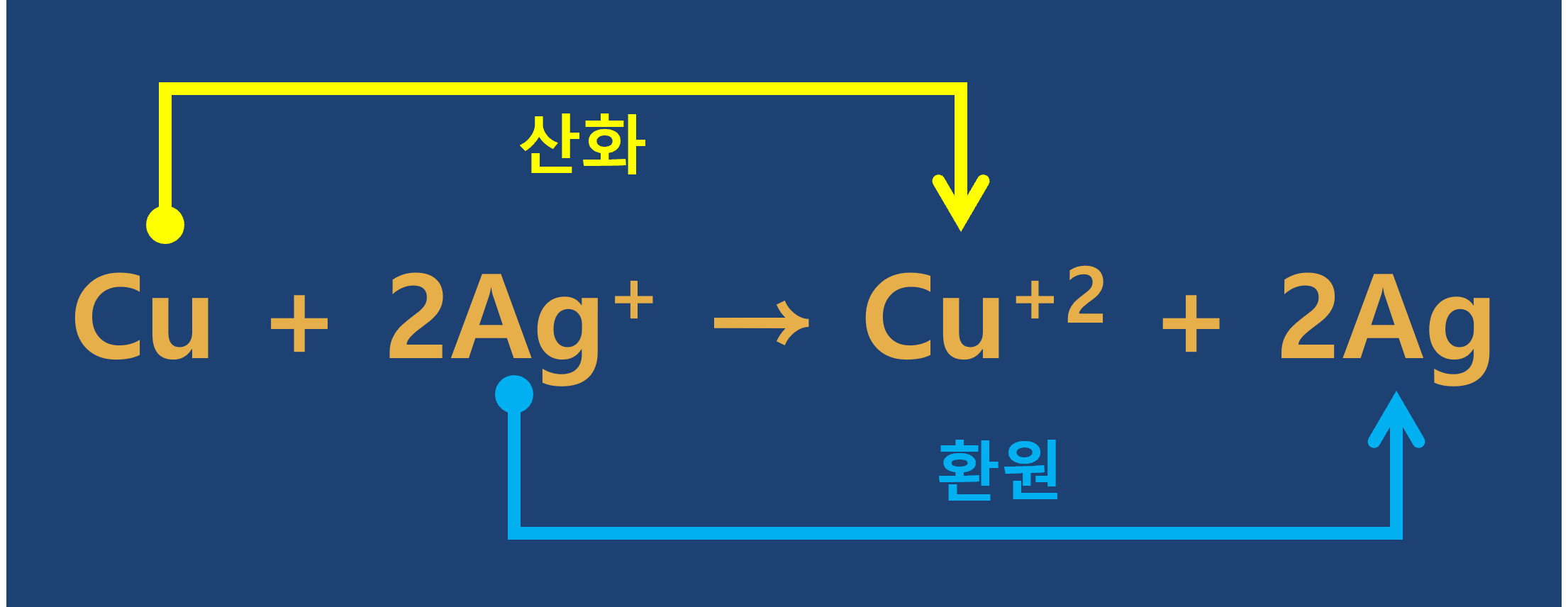
② 구리와 질산은 수용액의 반응
㉠
-
㉡ 수용액에 녹아 있던
-
㉢ 구리와 은의 산화-환원 반응
4. 산화-환원 반응의 동시성
산화물이 환원될 때 탄소나 수소가 있으면 쉽게 환원됩니다. 이것은 탄소나 수소가 자기 자신은 산소와 결합하여 산화되면서 다른 물질이 환원시키기 때문입니다. 이와 같이 산화 반응과 환원 반응은 동시에 일어나는데 이것을 산화-환원 반응의 동시성이라고 합니다.
★ 참조 _ 금속의 이온화 경향
| 산화 | 환원 |
- 한 원자의 산화수가 증가하면 다른 원자의 산화수는 감소합니다.
1) 산화수
전자의 이동이 뚜렷이 나타나지 않은 공유 결합 물질이 포함된 화학반응에서 산화-환원 반응을 설명하기 위해 도입된 개념이 산화수입니다.
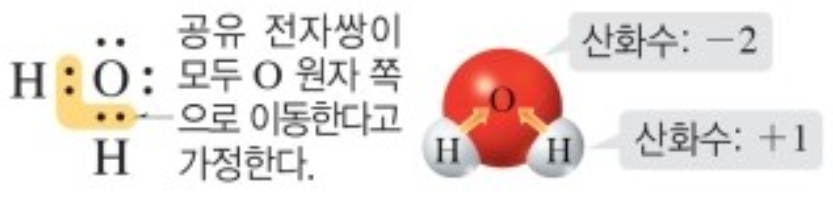
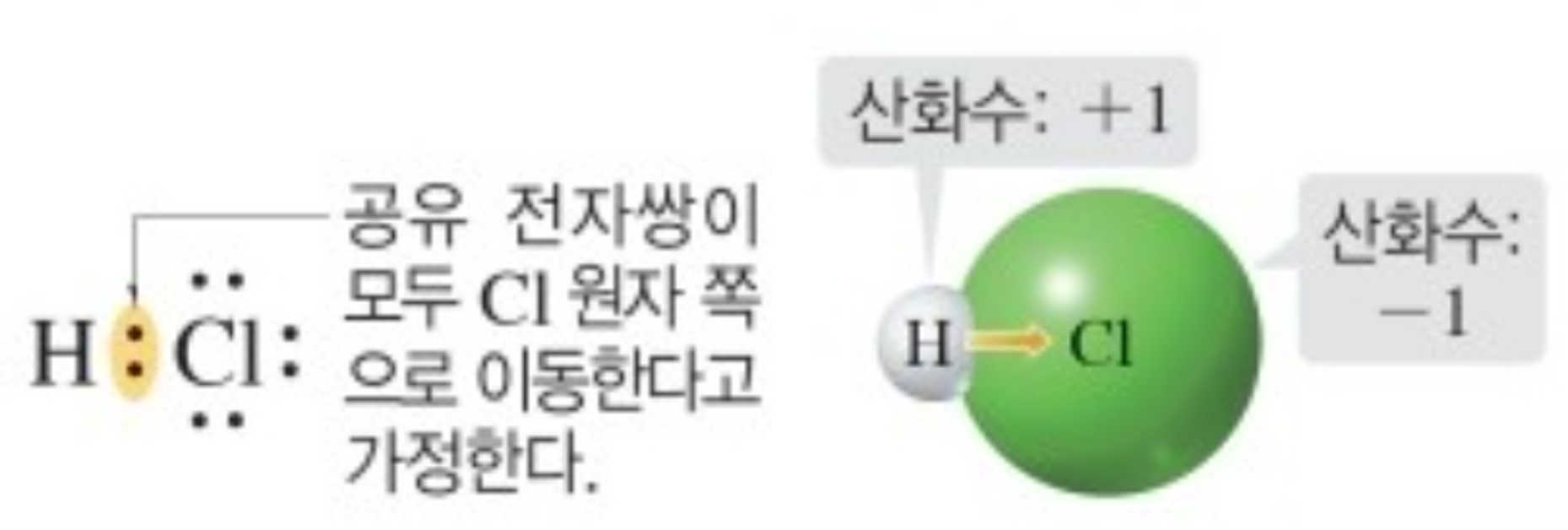
① 공유 결합 화합물
구성 원자 중 전기 음성도가 큰 원자 쪽으로 공유 전자쌍이 모두 이동한다고 가정할 때, 각 원자가 가지는 전하입니다. (전자를 잃은 상태 : '+, 전자를 얻은 상태 : '-'로 표시합니다.)
예1) 물을 구성하는 원자의 산화수 (전기음성도 :
예2) 염화수소를 구성하는 원자의 산화수 (전기음성도 :
② 홑원소 물질
- 전자가 어느 쪽으로도 치우치지 않았기 때문에 산화수는 0이 됩니다.
③ 이온 결합 화합물
- 양이온과 음이온이 결합된 이온 결합 물질에서 양이온은 중성 상태의 원자가 전자를 잃고 형성되며, 음이온은 중성 상태의 원자가 전자를 얻어 형성됩니다. 따라서 각 이온의 전하가 그 이온의 산화수입니다.
예)
2) 산화수 규칙
- 아래 포스팅 참조 바랍니다.
★ 참조 _ 산화-환원에서 전자의 이동, 산화수와 산화상태
3) 산화수 변화와 산화-환원
① 산화 : 산화수가 증가하는 반응
② 환원 : 산화수가 감소하는 반응
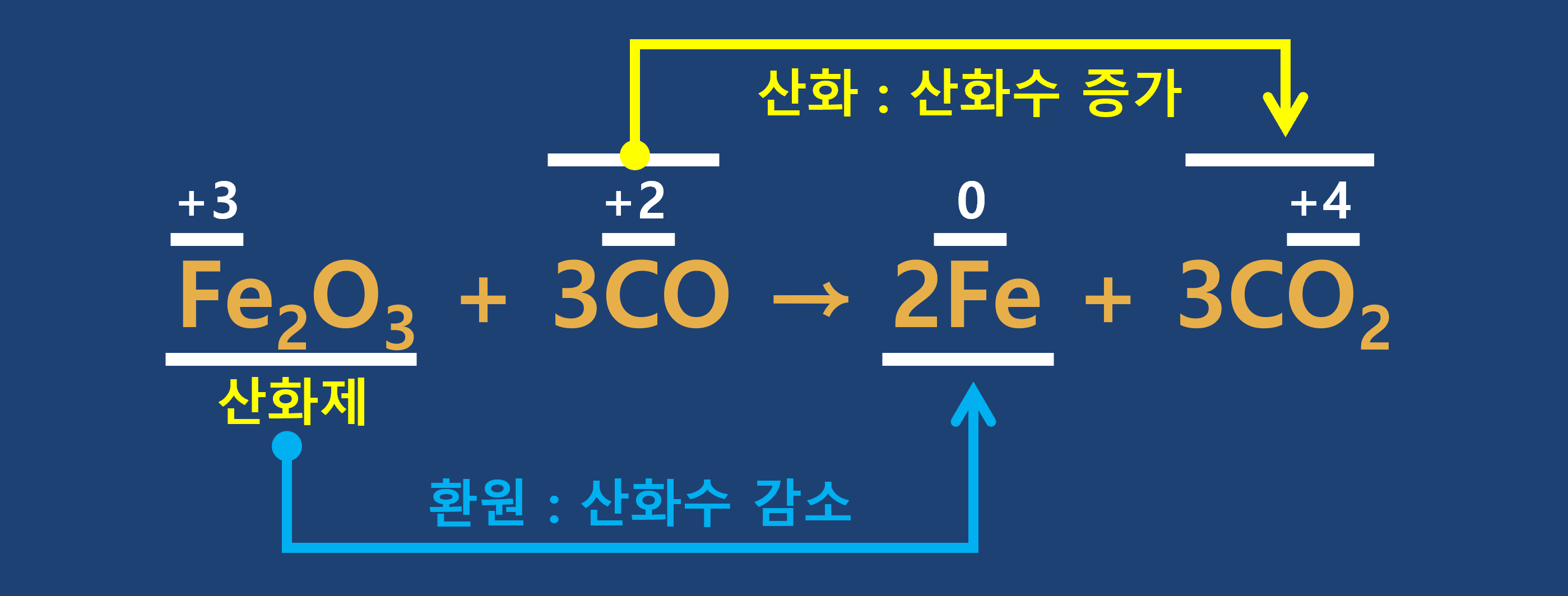

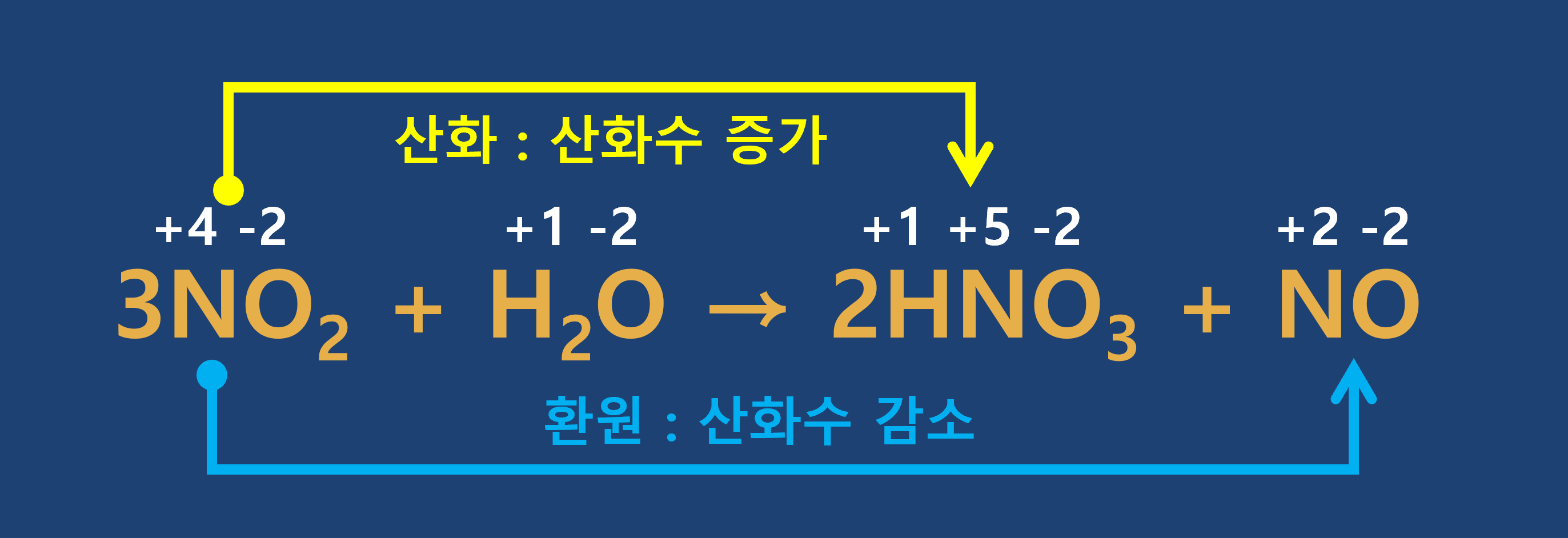
★ 반응 전과 후에 산화수가 변하는 원자가 없다면 산화-환원 반응이 아님에 유의하세요.
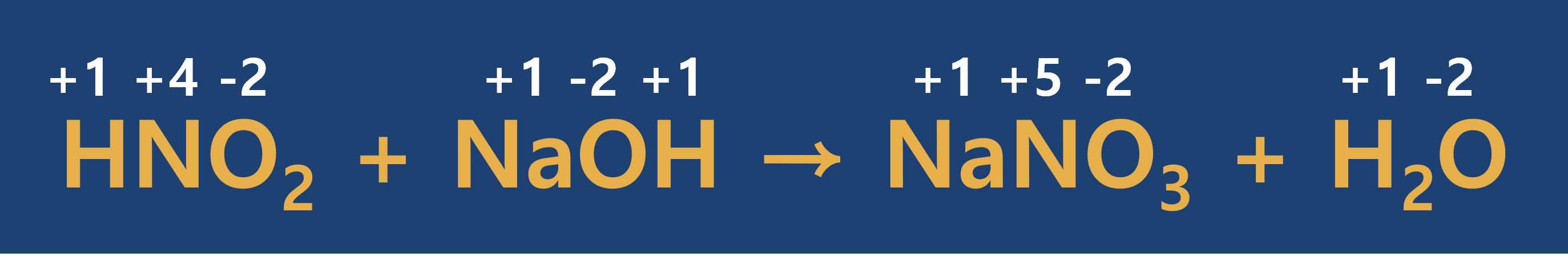
이번 시간에는 산화-환원 반응(산화제와 환원제)에 대해 알아보았습니다. 이 부분은 다음 시간에 포스팅할 화학반응식 작성하기에서 중요한 부분을 담당하게 됨으로 반드시 숙지하시기 바랍니다.

'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 산화·환원 반응 균형 맞추기(완성하기), 반쪽 반응법(산성 용액에서, 염기성 용액에서), 이온 전자법 (0) | 2023.12.09 |
|---|---|
| 산화·환원 반응, 산성 용액과 염기성 용액에서 균형 맞추기 (1) | 2023.12.08 |
| 화학반응(chemical reactions)의 종류 8가지, 합성(결합) 반응, 연소 반응, 분해반응. 단일치환반응, 이중치환반응, 산-염기반응. 산화-환원 반응, 앙금생성반응 (0) | 2023.12.04 |
| 화학식(분자식)을 만드는 규칙(방법) (1) | 2023.12.03 |
| 화학식(분자식) 연습문제 (0) | 2023.12.02 |




댓글