산화-환원 반응식은 물질 사이에서 전자를 주고받는 화학반응을 나타내는 식입니다. 산화-환원 반응 균형 맞추기란, 반응 전과 후의 원자 수와 전하가 같도록 반응물과 생성물의 계수를 조절하는 것을 말합니다.
산화-환원 반응 균형 맞추기에는 여러 가지 방법이 있습니다. 그중에서 가장 널리 쓰이는 방법은 반쪽 반응법 또는 이온-전자법이라고 합니다.
이번 시간에는 저와 함께 산화·환원 반응 균형 맞추기 즉, 산화·환원 반응식 완성하기에 대해 공부하겠습니다. 안전벨트 확인하셨으면 출발하겠습니다.

산화·환원 반응 균형 맞추기
산화·환원 반응식은 계수를 맞춘 산화·환원 반응식을 완성하여 필요한 산화제와 환원제의 양을 구할 때 사용합니다.
1. 산화·환원 반응의 양적 관계
산화·환원 반응의 양적 관계를 통해 완성된 산화·환원 반응식으로부터 산화나 환원에 필요한 산화제나 환원제의 양을 알 수가 있습니다.

- 산화제인
2. 산화수법(산화상태법) : 증가한 산화수 = 감소한 산화수
산화수법(산화상태법)은 산화수와 감소하는 산화수가 같다는 것을 이용하는 방법입니다. 즉, 산화·환원 반응에서 증가한 산화수와 감소한 산화수는 항상 같으므로 이를 이용한 산화·환원 반응식을 완성합니다.
① 반응의 균형을 맞추기 위해 모든 원소의 산화상태를 알고 있어야 합니다.
② 산화상태의 총 증가분이 총 감소분과 일치하도록 만드는 반응물의 계수를 찾아야 합니다.
1) 메틸알콜( CH3OH
-
① 탄소원자 한 개의 산화 상태 증가분과 균형을 맞추기 위하여 세 개의 산소 원자가 필요함을 의미합니다.
② 나머지 부분의 균형을 맞춥니다.
③ 양변에 2를 곱하여 줍니다.
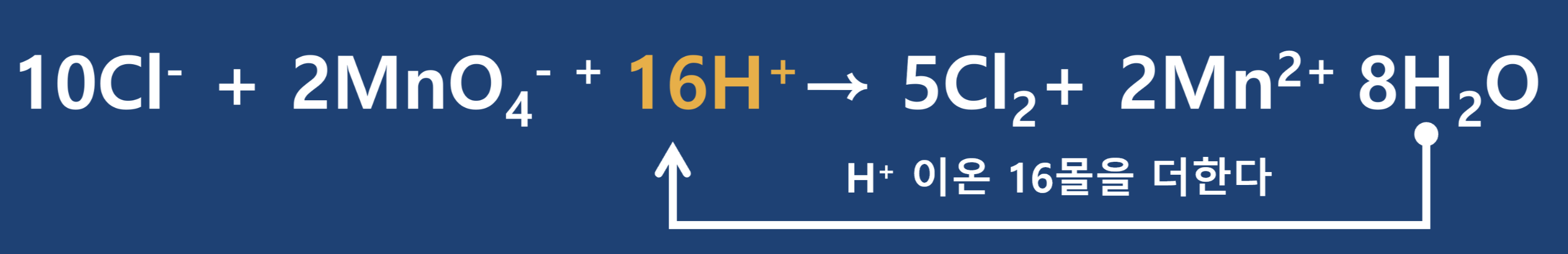
2) 산성 용액에서 옥살산 이온과 과망가니즈산 이온의 반응 균형 맞추기
① 반응물을 화살표의 왼쪽에, 생성물을 화살표의 오른쪽에 쓰고 각 원자의 산화수를 구합니다.

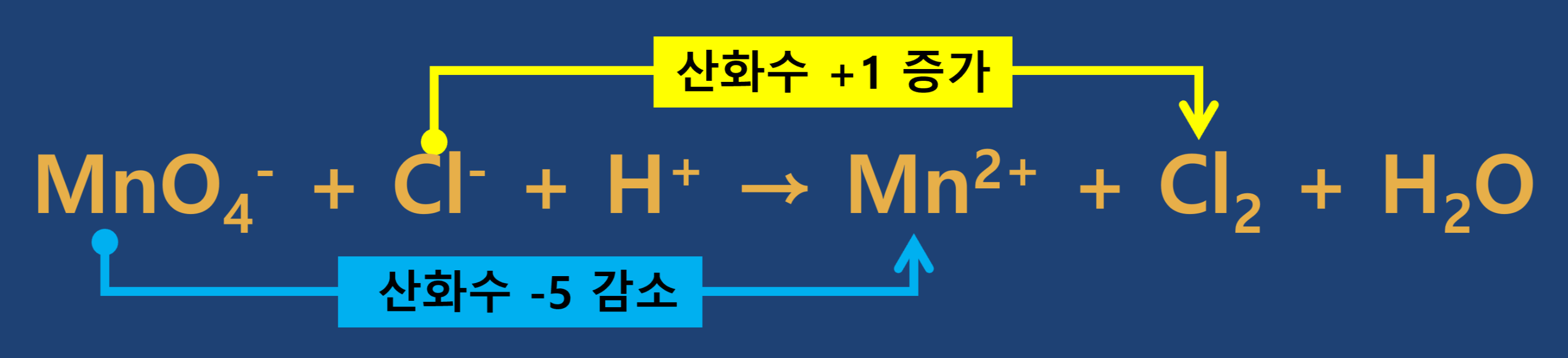
② 반응 전·후의 산화수 변화를 확인합니다.

③ 산화되는 원자 수와 환원되는 원자 수가 다른 경우 산화되는 원자 수와 환원되는 원자 수를 맞추고, 증가한 산화수와 감소한 산화수를 각각 계산합니다.
- 반응물의 탄소는 2개인데 생성물의 탄소는 1개밖에 없으므로 양변에 계수를 맞추기 위해 생성물에 2를 추가하여 계수를 맞추어 줍니다.

④ 증가한 산화수와 감소한 산화수가 같도록 계수를 맞추어 줍니다.
- 양변의 계수를 맞추기 위해 최소공배수를 활용합니다.

⑤ 산화수 변화가 없는 원자들의 수가 같도록 계수를 맞추어 산화·환원 반응식을 완성합니다.
- 반응물에서 산소가 8개 있으므로 생성물에 물이 8몰 필요함을 알 수 있고, 더불어 수소가 16개 있으므로 반응물에 수소 16개를 채워주면 반응식이 완성됩니다.

반응법 - 산성 용액에서
① 산화 및 환원 반쪽 반응식을 만듭니다.
② 수소와 산소를 제외한 모든 원소의 균형을 맞춥니다.
③
④
⑤ 전자를 이용하여 전하의 균형을 맞춥니다.
⑥ 두 반쪽 반응에서 이동한 전자수를 맞추기 위하여 한쪽 혹은 양쪽의 균형 반쪽 반응식에 정수를 곱합니다.
a × 5 + b
⑦ 반쪽 반응식을 더하여 같은 화학종을 없앱니다.
위의 내용을 아래를 참조 하시면 조금은 더 이해가 편하실 것입니다.
- 1단계
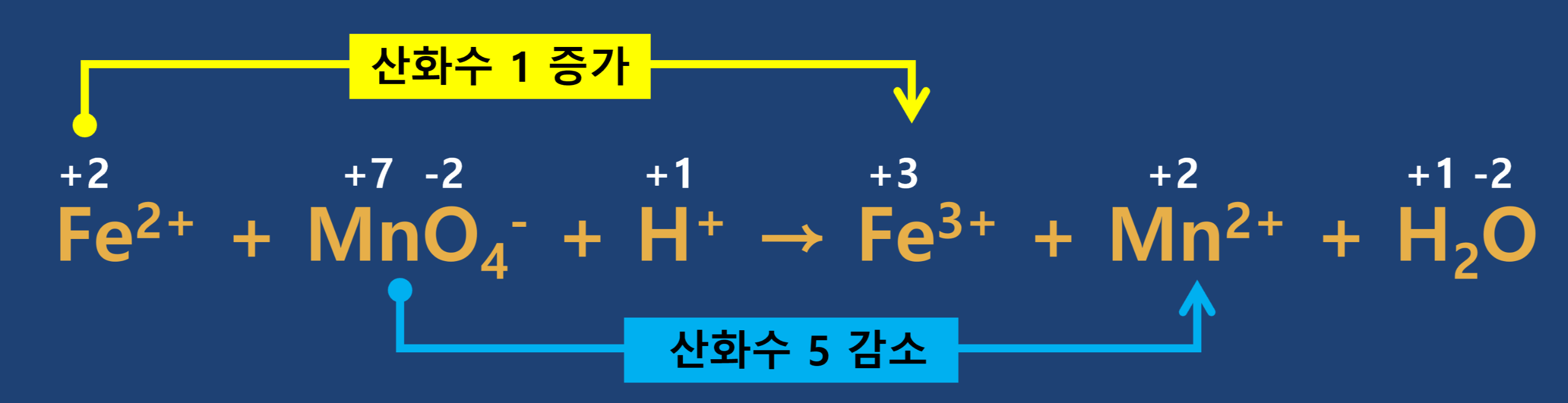
반응에 관여한 각 원자의 산화수를 구합니다.
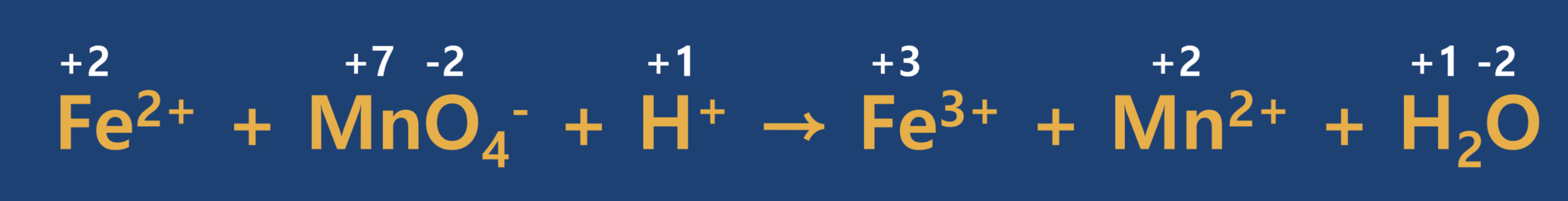
- 2단계
반응 전·후의 산화수 변화를 확인합니다.
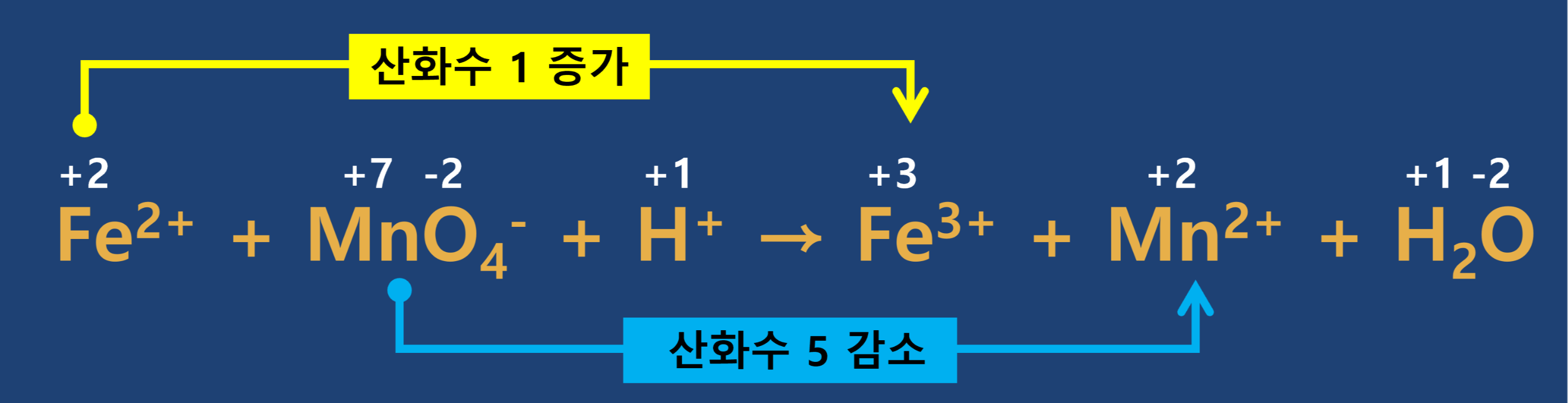
- 3단계
증가한 산화수와 감소한 산화수가 같도록 계수를 맞추어 줍니다.
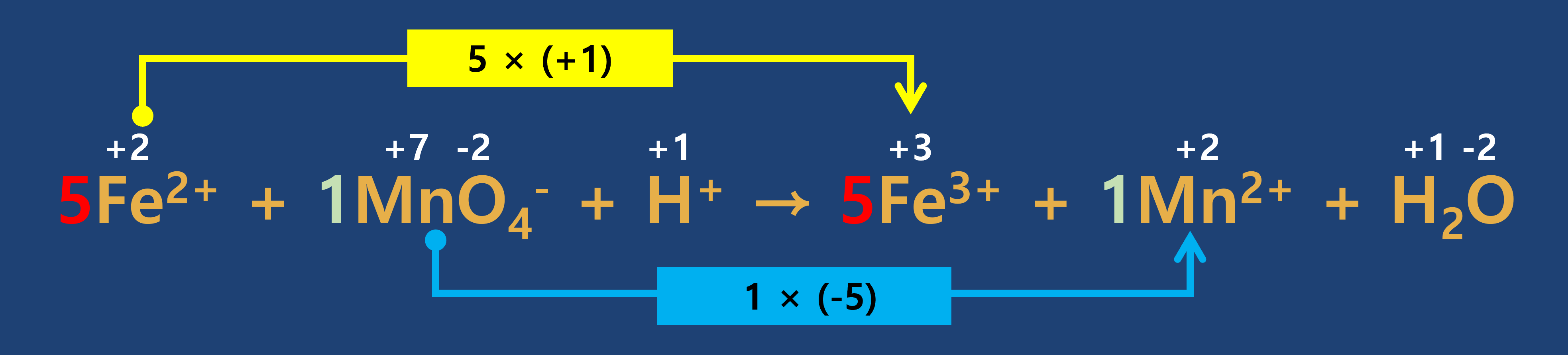
- 4단계
반응 전·후의 원자 수가 같도록 계수를 맞추어 줍니다.

★ 위의 내용을 좀 더 간략히 실제 과정을 통해 설명드리도록 하겠습니다.
■ 계수가 변하지 않는 경우 예시
- 1단계 : 각 원자의 산화수를 구합니다.
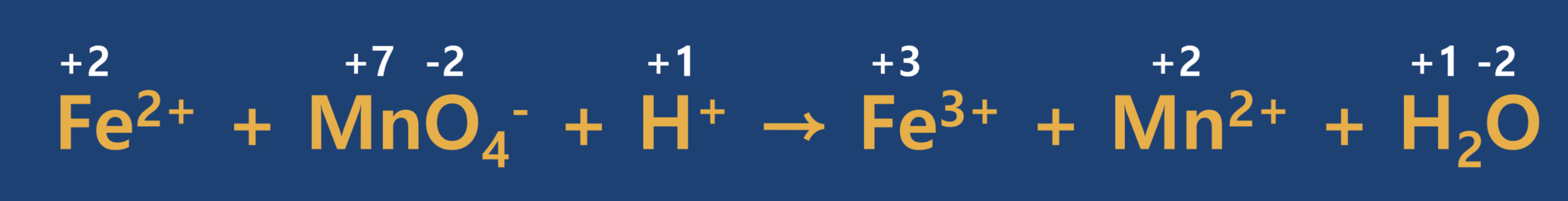

- 2단계 : 산화 반쪽 반응과 환원 반쪽 반응으로 나누어 줍니다.
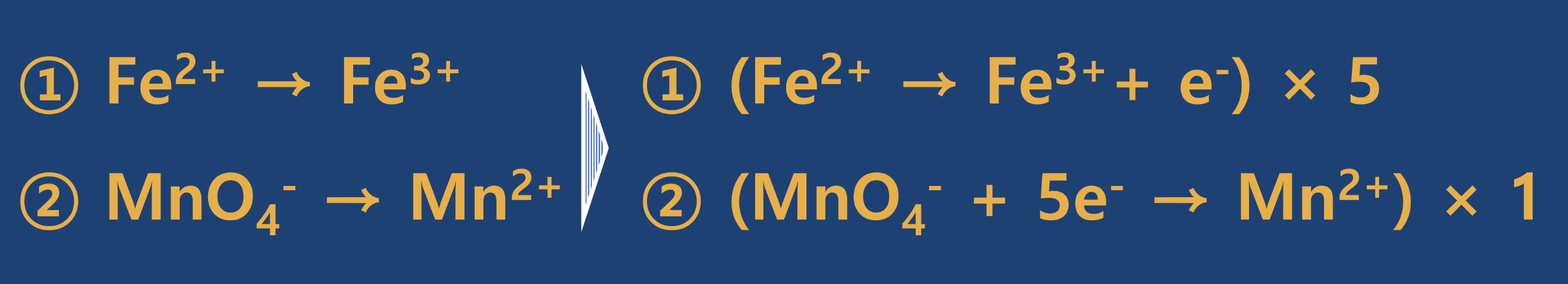
- 3단계 : 각 원소의 계수가 변하는 것은 없으므로 산화와 환원에 기여한 전자수가 같도록 최소공배수를 활용하여 맞추어 주고, 산화와 환원의 반쪽 반응을 더하여 식을 만듭니다.
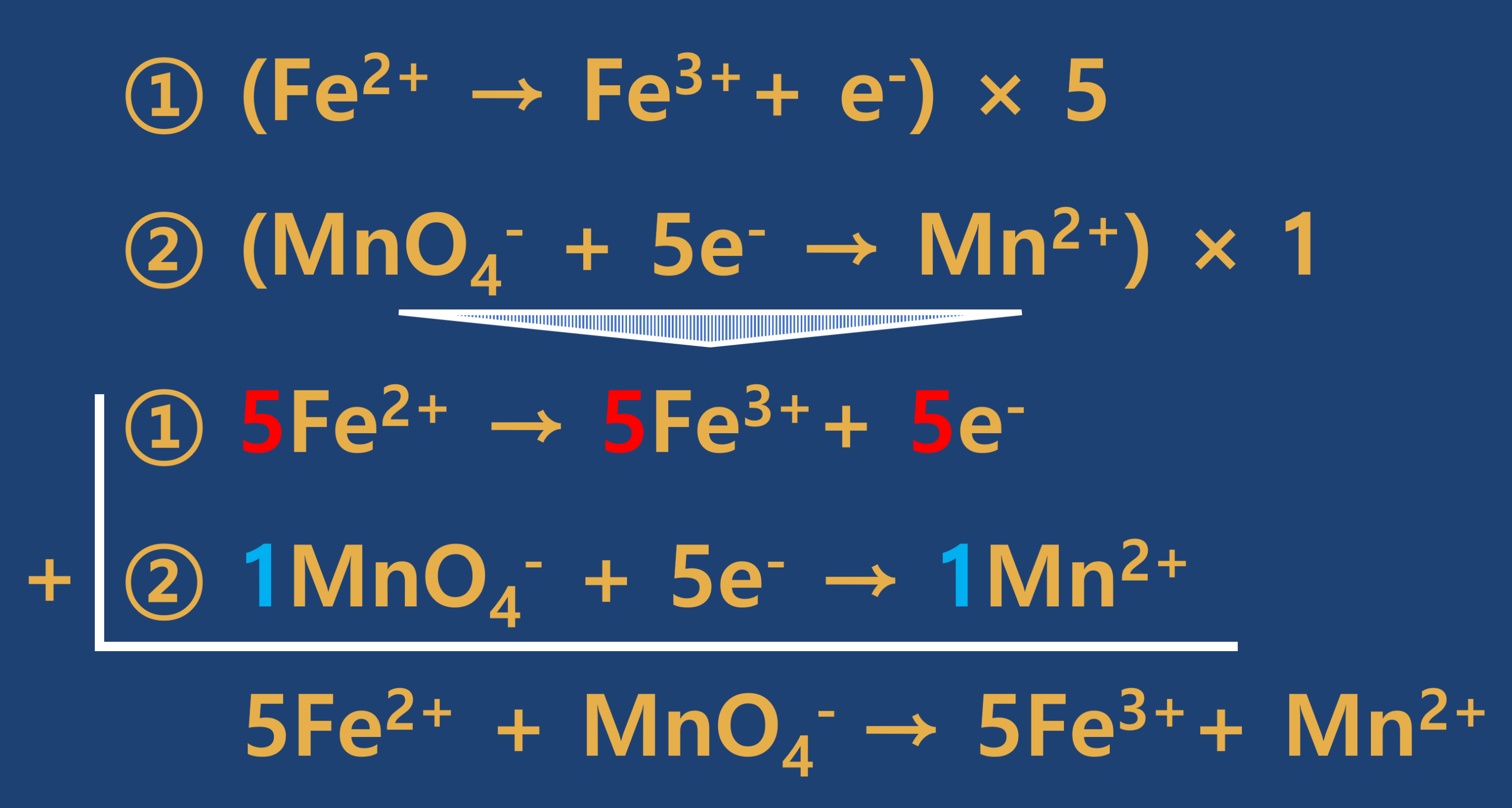
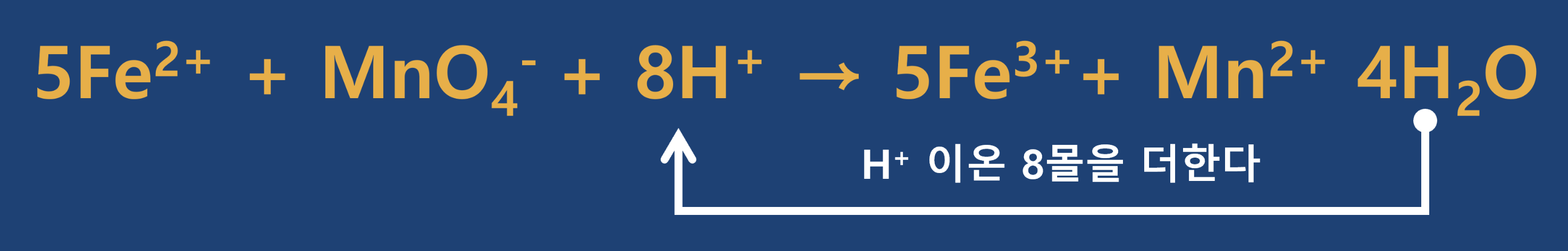
- 4단계 : 좌변과 우변에서 나머지 원소들의 균형(계수)을 맞추어 줍니다. 먼저 좌변에는 산소가 4개 있는 우변에는 없으므로 우변에 H2O

- 5단계 : 우변에 H
■ 계수가 변하는 경우 예시
- 1단계 : 각 원자의 산화수를 구합니다.

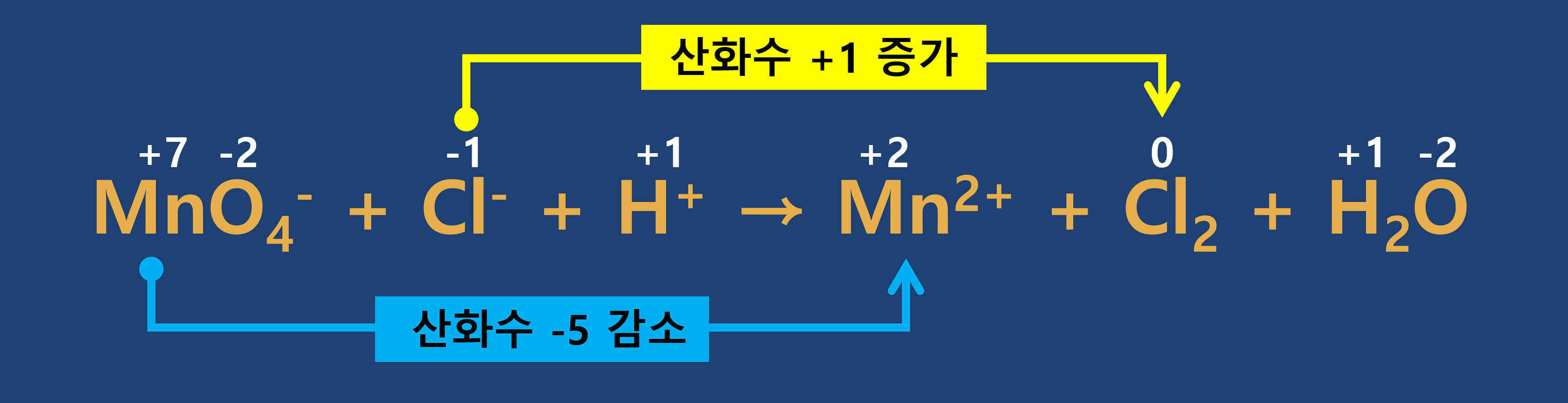
- 2단계 : 산화 반쪽 반응과 환원 반쪽 반응으로 나누어 줍니다.
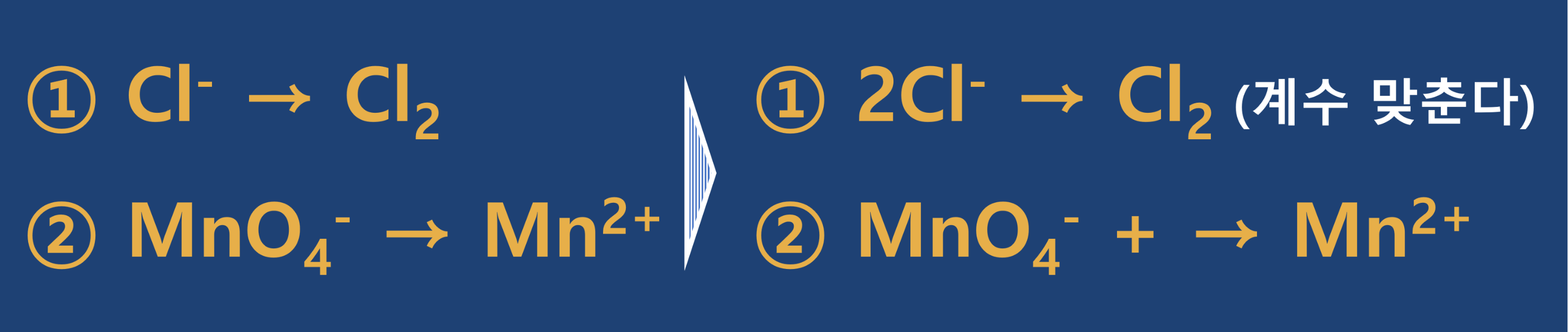

- 3단계 : 각 원소의 계수가 변하는 것에 주의하여 산화와 환원에 기여한 전자수가 같도록 최소공배수를 활용하여 맞추어 주고, 산화와 환원의 반쪽 반응을 더하여 식을 만듭니다.
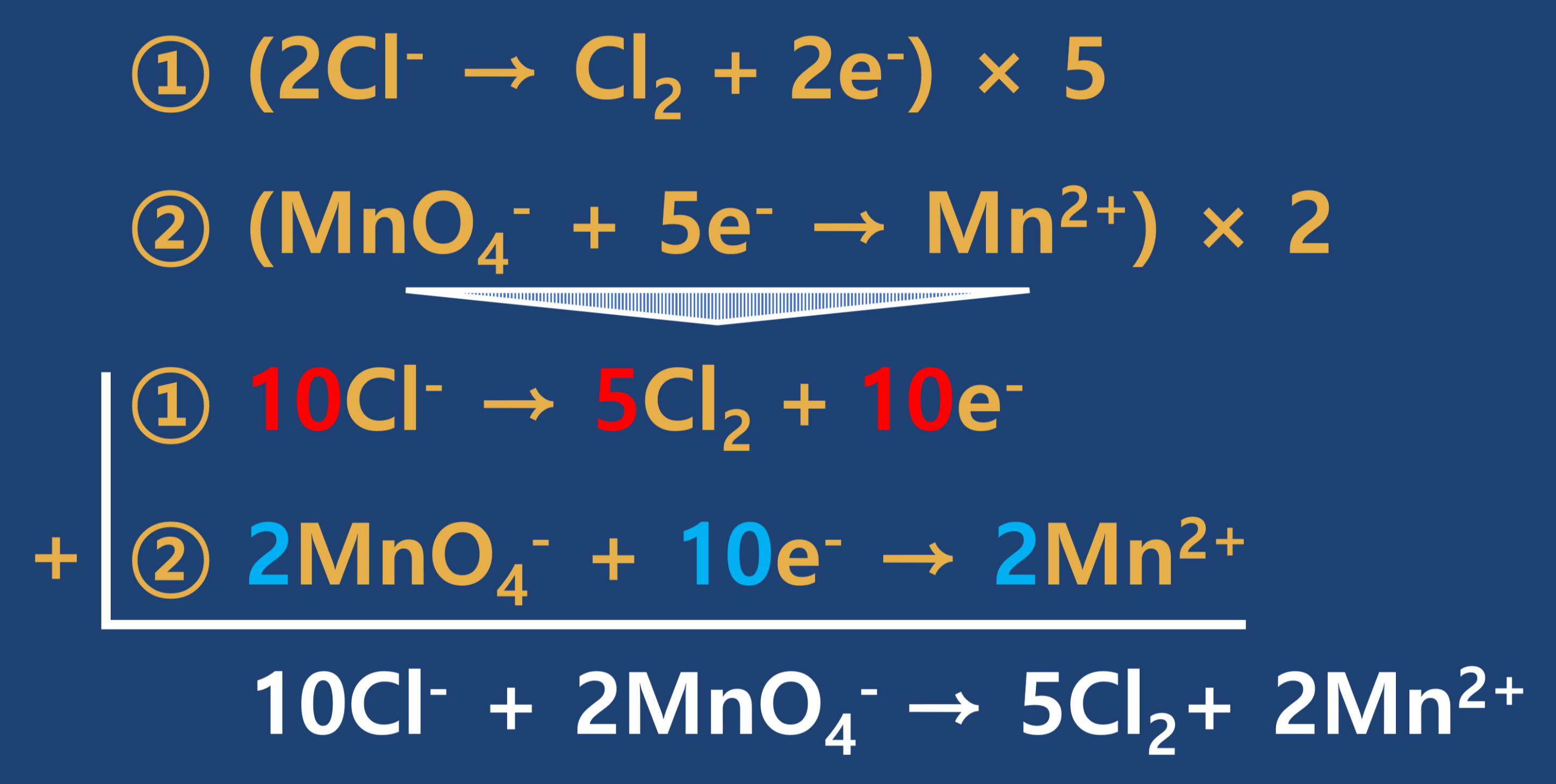
- 4단계 : 좌변과 우변에서 나머지 원소들의 균형(계수)을 맞추어 줍니다. 먼저 좌변에는 산소가 8개 있는 우변에는 없으므로 우변에 H2O
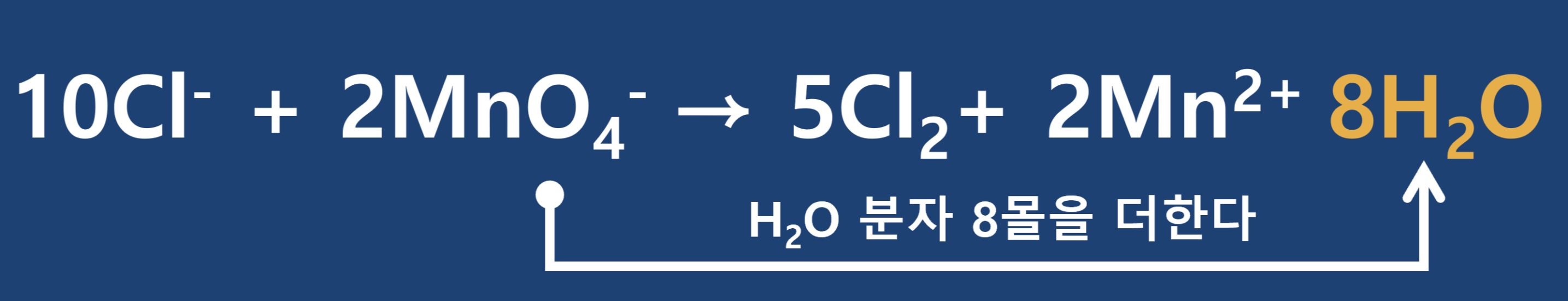
- 5단계 : 우변에 H
이온 전자법
산화-환원 반응은 산화 반쪽 반응과 환원 반쪽 반응이 결합된 것임을 이용하는 방법입니다.
- 1단계
각 원자의 산화수를 구합니다.
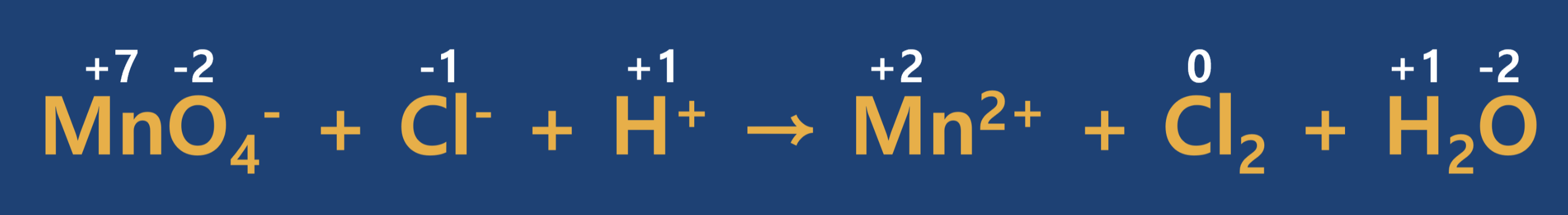
- 2단계
산화·환원 반응을 산화 반응과 환원 반응으로 나눕니다.
① 산화 :
② 환원 :
- 3단계
원자의 종류와 수가 같도록 계수를 맞추어 줍니다.
① 산화 :
② 환원 :
- 4단계
화살표 양쪽의 전하량이 같도록 맞추어 줍니다.
- 양쪽의 계수를 맞추기 위해
① 산화 :
② 환원 :
- 5단계
잃은 전자 수와 얻은 전자 수가 같도록 계수를 맞추어 줍니다. (최소공배수 활용)
① 산화 : (
② 환원 : (
- 6단계
두 반쪽 반응을 더하여 산화·환원 반응을 완성합니다.

★참고 _ 반쪽 반응법 - 염기성 용액 계산법
이번 시간에는 산화·환원 반응 균형 맞추기(완성하기), 반쪽 반응법(산성용액에서), 이온 전자법에 대해 말씀드렸습니다. 보기에는 복잡해 보이지만 규칙만 알고 있으면 별로 어렵지 않습니다. 반복이 어려움을 극복하게 해 줄 것입니다. 여러분이 원하는 자격증 시험에 합격하는 날까지 여러분을 돕도록 하겠습니다. 늘 응원합니다.

'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 분자 반응식 작성하기, 분자 반응식 쓰기, 분자 반응식 만들기 (0) | 2023.12.12 |
|---|---|
| 화학 반응식 쓰기와 균형 맞추기 – 화학 반응식을 쓰고 균형을 맞출 수 있다 (0) | 2023.12.11 |
| 산화·환원 반응, 산성 용액과 염기성 용액에서 균형 맞추기 (1) | 2023.12.08 |
| 산화-환원 반응(산화제와 환원제) (0) | 2023.12.06 |
| 화학반응(chemical reactions)의 종류 8가지, 합성(결합) 반응, 연소 반응, 분해반응. 단일치환반응, 이중치환반응, 산-염기반응. 산화-환원 반응, 앙금생성반응 (0) | 2023.12.04 |




댓글