이온(ionic)은 원자나 분자가 전자를 잃거나 얻어서 전하를 띠게 된 입자입니다. 원자나 분자가 전자를 잃으면 양전하를 띠는 양이온이 되고, 전자를 얻으면 음전하를 띠는 음이온이 됩니다. 이온은 전기적으로 중성인 원자나 분자와는 다른 화학적 성질을 나타냅니다.
예를 들어, 나트륨은 원자 상태에서는 반응성이 강한 금속이지만, 전자를 잃어서 나트륨 이온이 되면 염화나트륨과 같은 이온 결합 화합물을 형성할 수 있습니다. 이온은 물에 녹으면 전해질이 되어 전류를 전달할 수 있습니다.
이번 시간에는 이온(ionic)에 대해 알아보겠습니다.
목차
1. 이온(ionic)이란
2. 양이온
- 양이온 명명법
3. 음이온
- 음이온 명명법
4. 주기율표의 양이온과 음이온
5. 다원자 이온의 이온식과 원자가
1. 이온(ionic)이란
탄소(C) 원자, 수소(H) 원자, 산소(O) 원자 등의 모든 원자(Atom)는 전기적으로 중성을 띕니다. 중성인 원자가 전자$(e^-)를 잃거나 얻으면 이온이 됩니다. 다시 말하면 중성 원자에서 전자를 얻거나 잃어서 전하를 띤 물질을 이온이라고 합니다.
| 구분 | 내용 |
| 이온 | 전기적으로 중성인 원자가 (-)전하를 띤 전자를 잃거나 얻어서 전하를 띠게 된 입자 |
| 양이온 | 중성의 원자가 전자를 잃어 (+)전하를 띠는 입자 |
| 전자 1개를 잃으면 +1의 양이온, 전자 2개를 잃으면 +2의 양이온 | |
| 음이온 | 중성의 원자가 전자를 얻어 (-)전하를 띠는 입자 |
| 원자핵의 전하량 < 전자의 총 전하량 |
- 이온이 될 때 변하는 것과 변하지 않는 것
|
변하는 것
|
전자수, 원자 크기
|
|
변하지 않는 것
|
원소 종류, 원자핵의 전하량, 질량
|
2. 양이온(Cation)
중성인 원자 또는 원자단이 전자를 잃으면 양(+)전하를 띤 물질이 됩니다. 이 물질을 양이온(Cation)이라고 합니다.
예)
- 양이온 명명법
원소 기호의 오른쪽 위에 잃은 전자수와 이온이 띠고 있는 (+)전하를 함께 나타내며, 양이온의 이름은 원소 이름 뒤에 ‘~이온’을 붙입니다.
① 금속 양이온
- 주기율표의 금속 원소의 이름 + 이온
② 금속이 전하가 다른 두 가지 이상의 양이온이 되면
- 금속 원소 이름 뒤의 괄호 안에 로마 숫자로 전하를 표시한다
③ 비금속 양이온
- –ium(–늄)을 붙인다
3. 음이온(anion)
중성인 원자(예. Cl) 또는 원자단이 전자를 얻으면, 음(-) 전하를 띤 물질(예.
예)
- 음이온 명명법
원소 기호의 오른 쪽 위에 얻은 전자수와 이온이 띠고 있는 (-)전하를 함께 나타내며, 음이온의 이름은 원소 이름 뒤에서 ‘소’를 생략하고 ‘~화 이온’으로 부릅니다. 음이온을 구성하는 ① 원자의 개수 ② 원소의 종류에 따라 음이온 명명법이 다르게 되므로 이점에 유의하여 공부하여야 합니다. (이 부분은 반드시 암기하시기 바랍니다.)
① 단원자 음이온
- 원소 이름의 끝부분을 –ide(–화)로 바꿉니다.
| 구분 | 명명법 | |
| 영어 | 한글 | |
| Hydride | 수소화이온 | |
| Oxide | 산화이온 | |
| Sulfide | 황화이온 | |
| Nitride | 질소화이온 | |
| Iodide | 아이오딘화이온 | |
| Bromide | 브로민화이온 | |
| Chloride | 염화이온 | |
| Fluoride | 플루오린화이온 | |
② 이온자 음이온
- 원소 이름의 끝부분을 –ide(–화)로 바꿉니다.
③ 다원자(3원자 이상) 음이온
㉠ 산소를 포함하는 다원자 이온
- 끝에 –ate(–산) 또는 –ite(아~산)를 붙여서 부릅니다.
ㆍ
ㆍ
㉡ 할로겐 + 산소 음이온
-
| 기준보다 산소 원자 1개 더 많음 |
기준 음이온 | 기준보다 산소 원자 1개 더 적음 |
기준보다 산소 원자 2개 더 적음 |
| 과염소산이온 | 염소산이온 | 아염소산이온 | 차아염소산이온 |
| Per ~ ate | ~ate | ~ite | Hypo ~ ate |
| Perchlorate | chlorate | chlorite | Hypochlorate |
㉢
- 음이온 앞에 수소(hydrogen) 또는 이수소(dihydrogen)를 붙여서 부릅니다.
4. 주기율료의 양이온과 음이온
| 구분 | 이온 | ||||
| 양이온 | 1족 | ||||
| 2족 | |||||
| 음이온 | 6족 | ||||
| 7족 | |||||
5. 다원자 이온의 이온식 및 원자가
- 아래표는 반드시 암기하시기 바랍니다.
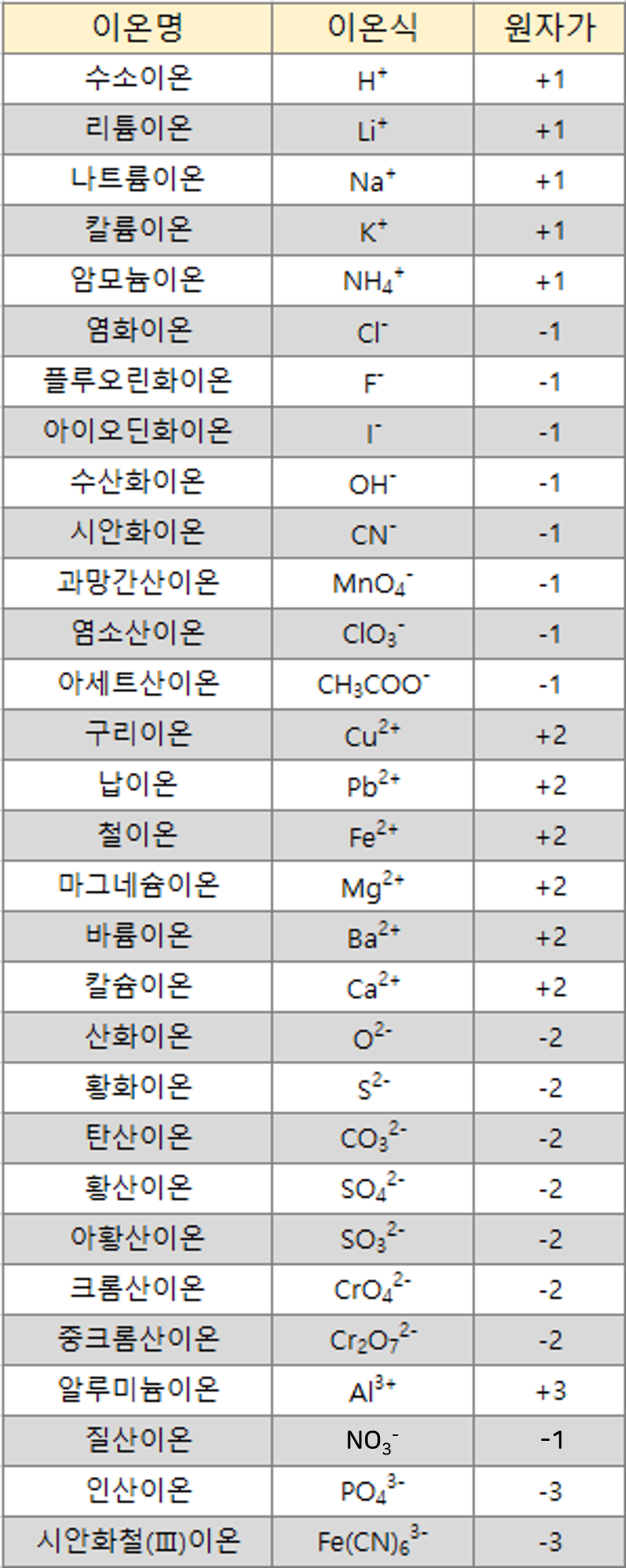
이번 시간에는 이온(양이온과 음이온)이란 무엇인지와 이온결합 화합물 명명법(양이온, 음이온)에 대해 알아보았습니다. 오늘 공부한 내용은 하나의 규칙입니다. 규칙은 이해 영역보다는 암기 영역입니다. 이런 부분 참고하시면 좋을 것 같습니다.

'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 산화-환원(redox, 酸化還元), 전자의 이동, 산화수와 산화상태 (0) | 2023.11.29 |
|---|---|
| 전기음성도(전기력), 금속의 이온화 경향, 금속과 비금속의 양쪽성 원소, 암기법 (1) | 2023.11.28 |
| 이온결합 화합물 실험식(화학식) 작성 방법 (0) | 2023.11.28 |
| Hill system! 화학식 표기방법(실험식, 분자식) (0) | 2023.11.26 |
| 일반화학 원소 주기율표 암기하지 말고 이해하자, 원소주기율표 만들기 치트키와 암기법 (위험물기능장 자격증 취득 대비) (0) | 2022.02.28 |




댓글