일반화학 원소 주기율표 암기하지 말고 이해하자, 원소주기율표 만들기 치트키와 암기법 (위험물기능장 자격증 취득 대비)
위험물 기능장 자격증 취득을 위해서는 반드시 극복해야 할 과목이 있다. 바로 일반화학이다. 일반화학을 정복하지 않고 위험물 기능장 자격증 취득은 요원할 수밖에 없다. 일반화학을 공부하는 첫걸음은 원소주기율표를 암기하는 데 있다. 우리가 수학을 공부하기 위해 가장 먼저 했던 것이 구구단 암기였던 것을 상기하기 바란다.
암기는 모든 공부에서 반드시 필요한 테크닉이다. 하지만 이해가 수반하지 않는 암기 위주 공부는 성적을 비약적으로 상승시킬 수 없다. 또 다양한 시험문제 유형에 대응하기도 어렵다. 원소주기율표는 모두가 암기하는 것이라 알 고 있다. 하지만 이제는 이해하자. 이해하는 것이 암기보다 훨씬 쉽다. 오늘 그 비법을 공개한다.
1. 원소주기율표
원소들을 원자 번호 순으로 나열했을 때, 성질이 비슷한 원소들이 일정한 간격을 두고 주기적으로 반복되는 것을 주기율이라고 한다. 주기율표는 주기율에 따라 원소들을 배열한 표를 말한다.
원소주기율표는 원소를 구분하기 쉽게 성질에 따라 배열한 표를 말한다. 러시아 드미트리 멘델레예프가 처음 제안했다. 1913년 헨리 모즐리는 멘델레예프의 주기율표를 개량시켜서 원자 번호순으로 배열했는데, 이는 현대의 원소 주기율표와 유사하다. 가장 많이 쓰이는 주기율표에는 단주기형과 장주 기형이 있다. 단주기형 주기율표는 1주기와 3주기를 기준으로 하고, 4주기 아래로는 전형 원소와 전이 원소가 같은 칸에 있다. 이 단주기형 주기율표는 초기에 쓴 모델로 원자가 많이 알려지지 않았을 때 많이 사용하였다. 장주기형 주기율표는 현재 가장 많이 쓰고 있는 주기율표이다.

이렇게 복잡해 보이는 주기율표를 이제는 아래와 같이 단순화된 주기율표로 바꾸어 암기하면 된다. 아니 암기가 아니고 이해하면 된다.

어떤가? 이 정도라면 충분히 할 수 있다는 자신감이 충만하지 않은가? 이 정도라면 이해를 넘어 잠깐만 연습하면 암기할 수 있을 것이다. 하지만 서두에 말했듯이 이해를 바탕으로 해야 한다. 이해를 바탕으로 해야 하는 이유가 있다. 변형된 원소주기율표에도 암기해야 할 내용이 많다. 우선 족과 주기에 맞춰 원소를 알아야 한다. 또 원소기호와 함께 원자량도 알아야 한다. 알아야 할 내용을 대폭 줄이기는 했지만 그냥 쉽게 볼 대상은 아니다.
2. 원소주기율 속의 주기와 족
주기율표에서 가로줄은 주기, 세로줄은 족이라고 한다.
주기율표에서 가로 줄 위치에 있는 원소들을 ‘주기’라고 한다. ‘주기’는 전자껍질의 수를 나타낸다. 전자껍질의 수는 원자 반지름을 결정하는 중요한 요소이며, 전자껍질의 수가 많을수록 원자 반지름은 증가한다.
가장 바깥쪽 전자껍질에 있는 전자는 전자를 잃거나 받으면서 화학결합에 참여하게 되는데 이를 ‘원자가 전자’라고 한다. 원자의 화학적 성질은 ‘원자가 전자’에 의해 결정된다. 18족에 속해 있는 원소들을 비활성 기체라 한다. 이들은 가장 바깥쪽 전자껍질에 8개의 전자를 갖고 있으나, 전자를 잃지도 받지도 않기 때문에 최외각 전자의 수는 0이다. 그러므로 18족을 제외한 나머지 전형 원소들은 최외각 전자의 수와 원자가 전자의 수가 같다.
주기율표에서 같은 세로 줄에 위치하면 같은 족이라 부른다. 같은 족은 화학적 성질을 결정하는 원자가 전자의 수가 같기 때문에 같은 족은 화학적 성질이 비슷하다. 즉 3주기 1족 원소인 나트륨(Na)은 전자껍질이 3개이고 원자가 전자 수가 1개이다. 리튬(Li)은 2주기 1족이며 전자껍질은 2개, 원자가 전자 1개를 갖고 있다. 그러므로 리튬(Li)과 나트륨(Na)을 같은 족이라 하며 이들의 화학적 성질은 비슷하다.
1족
수소를 제외한 1족 원소들은 알칼리 금속으로 리튬, 나트륨(소듐), 칼륨(포타슘), 루비듐, 세슘, 프랑슘이 있다. 반응성이 큰 금속으로 각 원자들은 8족 기체심을 가지며 원자가 껍질의 하나의 s전자를 가진다. 모든 금속들 중 가장 전기양성적인 알칼리 금속은 원자가 전자의 전자 하나를 잃고서 강한 반응을 일으킨다. 반응성이 커서 순물질로는 존재하기 어렵기에 주로 화합물 형태로 존재한다
2족
2족은 알칼리 토금속으로, 베릴륨, 마그네슘, 칼슘, 스트론튬, 바륨, 라듐이 있다. 최외곽 원자가껍질에 2개의 전자가 있다. 두 전자를 잃어버려 알칼리 금속처럼 하나의 산화상태 +2를 가진다. 베릴륨을 제외하고 대개 이온성 화합물을 형성한다. 알칼리금속처럼 반응성은 크지만 무르지는 않다.
대표적으로 마그네슘의 경우 반응성이 커서 연소 시 밝은 빛을 내며 타는 특징이 있다. 카메라 플래시, 불꽃놀이에 쓰인다. 은백색의 금속으로 하소 처리(열처리)하면 표면적이 매우 낮고 고밀도이며 화학적으로 비활성인 중소 마그네사이트가 되고 이는 모든 내화 산화물들 중에서 가장 높은 용융 온도를 가짐으로 염기성 내화벽돌로 이용되는 등 중요한 산업적 용도를 가진다.
또 다른 대표적인 원소로 칼슘이 있다. 칼슘은 산소화 반응해서 비료나 건축재료로 만들 수 있다. 소석회라고 하는 수산화칼슘은 산화칼슘과 물을 섞어 만들어지는데, 이게 바로 시멘트이다
3족
3족은 붕소, 알루미늄, 갈륨, 인듐, 탈륨, 니호늄이 있다. 원자가껍질 배치가ns2 np이다.이 족의 모든 원소는 +3의 산화상태의 화합물을 형성하거나 13족과 14족의 원소들은 1, 2, 13족의 원소들만큼 서로 닮은 점을 가지는 건 아니다.
4족
4족은 탄소, 규소, 저마늄, 주석, 납, 플레로븀이 있다. 탄소는 비금속 규소와 저마늄은 반도체 원소, 주석과 납은 금속으로, 이들 원소의 원자는 원자가 껍질에서 가진다. 14족의 모든 원소는 할로겐과 산소와의 화합물에서 +4인 산화상태를, 수소화물에서는 -4의 산화상태를 가진다. 네 개의 결합수가 균형을 이루면서 극성을 띄지 않는다.
5족
5족은 질소, 인, 비소, 안티모니, 비스무트, 모스코븀이 있다. 질소와 인은 5족에서 비금속이고, 비소와 안티모니는 반도체 원소, 비스무트는 금속이다. 원자가껍질에서 이들 원소의 원자는 ns2 np3배치를 가진다.
질소원자는 상당히 큰 전기 음성도를 가지며 원자가 껍질에 전자를 여덟 개보다 더 많이 수용시키지 못하기에 질소의 화학적 성질은 15족의 다른 원소와 본질적으로 다르고 질소는 염소만큼 전기 음성도가 크며 단지 플루오린과 산소만이 더 큰 전기 음성도를 가진다.
비금속인 질소와 인의 원자는 전자 3개를 얻으면 18족 기체 배치를 이룰 수 있고N-3 이온은 매우 전기 양성적인 금속과의 질소화합물에서 나타난다. 수소와의 공유 화합물인 경우에 원소들은 -3의 산화상태를 가지는 것으로 나타나는데, 그것은 수소가 이러한 화합물에서 항상+1의 산화수를 가지기 때문이며, -3의 산화상태는 금속과의 이온성 혹은 공유성 이 성분 화합물에서도 볼 수 있다.
6족
6족은 산소, 황, 셀레늄, 텔루륨, 폴로늄, 리버모륨이 있다. 산소와 황은 산소족 원소의 비금속 원소이며, 셀레늄과 텔루륨은 반도체 원소이고, 방사능 물질인 폴로늄은 텔루륨, 비스무트와 유사하지만 성질에 있어서도 주로 금속성을 띤다. 칼코겐 원소라고도 불린다.
7족
7족은 할로젠 원소이며 플루오린, 염소, 브로민, 아이오딘, 아스타틴, 테네신이 있다. 1족과 2족의 금속 원소들처럼 원소들끼리의 유사성이 크다.
할로겐족 원소들은 큰 전자 친화도,큰 전기 음성도,큰 이온화 에너지를 가지는 비금속으로 이 중에서 플루오린의 원자는 다른 할로겐 원자보다 매우 작으며, 가장 전기 음성도가 커서 반응성도 크다. 단, 아스타틴과 테네신은 비금속이 아닌 각각 준금속과 전이 후 금속으로 예상되고 있다.
주기가 커질수록 가림 효과로 인해 금속성이 강해지기 때문. 그러나 이들은 강한 방사능으로 인해 확인이 어렵기 때문에 위의 원소들과 함께 비금속 취급을 당하는 경우가 흔하다.
8족
8족은 비활성 기체로, 헬륨, 네온, 아르곤, 크립톤, 제논, 라돈, 오가네손이 있다. 비활성 기체 문서로. 비활성 기체족 원소들은 최외각 전자껍질이개(헬륨의 경우 2개)의 전자로 완전히 채워져 있어 낮은 화학적 활성을 지니며, 서로간에도 결합이 어려우므로 상온에서 기체로 존재한다. 단, 오가네손은 상대론적 효과로 인해 같은 족의 다른 원소들과는 매우 다른 성질[6]을 지닐 것으로 예측된다..
지금까지는 교과서적인 내요에 대해 알아보았습니다. 이제부터 본격적으로 오늘의 주제 원소주기율표 요리에 들어갑니다. 주기율표에는 족과 주기로 구분되어 있다. 족은 왼쪽에서 오른쪽으로 증가한다. 주기는 위에서 아래로 증가한다.
여기서 핵심은 족과 주기를 이해하는 데 있다. 그동안 우리는 선생님 말씀을 너무 잘 들었다. 그냥 암기하라고 해서 그냥 외웠다. 그냥~ 묻지도 따지지도 않고 그냥~~~ 무조건~~~ 묻지도 따지지도 말고 외우라고 하니까. 외웠다.
그런데 살다 보니 기억력은 떨어지고 기존 기억들이 가물가물하게 된다. 이제 이런 걱정 하지 않아도 됩니다. 서두에서 20개만 암기하면 된다고 했다. 아니 이해하라고 했다. 여기서 10분의 1인 2개만 암기하자! 다만 원소기호와 명칭은 암기해야 한다.
3. 원소주기율표 암기법
1) 암기 방법
① 1족 : 수리나칼
1족은 수(수소 )리(리튬) 나(나트륨) 칼(칼륨)
와오~~ 심심한데 술이나 깔까? 이렇게 연상하면 된다.
② 2족 : 베마칼
2족은 베(베릴륨) 마(마그네슘) 칼(칼슘)
택시요금 따블 부르고 빨리 잡아타고 가야 하는데 잡히진 않고, 비는 오지 아~~~
이런 상황에서 2배를 연상한다.
③ 3족 : 붕알
3족은 붕(붕소) 알(알루미늄)이다 좀 표현이 그렇지만 암기는 이렇게 할 때 더욱 잘된다.
3은 세(3) 즉, 세(3)붕알로 연상한다.
④ 4족 : 탄실
4족은 탄(탄소) 실(실리콘, 규소)
4는 4, 사(4)탄을 연상한다.
⑤ 5족 : 질인
5족은 질(질소) 인(인)
오질이 못난놈으로 연상한다.
⑥ 6족 : 산황
6족은 산(산소) 황(황)
6은 산소와 비슷하게 생겼다.
이렇게 연상한다.
⑦ 7족 : 불염
7족은 불(불소) 염(염소)
7은 불소와 닮았다.
이렇게 연상하면 된다.
⑧ 8족 : 헬네아
8(0)족은 헬(헬륨) 네(네온) 아(아르곤)
그냥 암기한다.
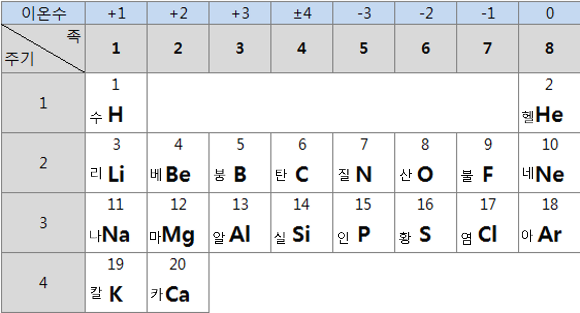
주기율표 모양을 기억하고 이것에 하나씩 채워가며 암기하면 아주 좋다. 이때 주의사항 사항이 있다. 1주기는 수소와 헬륨밖에 없다는 것이다.
2) 원자번호와 원자량 암기법
① 원자번호 구하기 (마법의 수 : 2, 10, 18)
㉠ 1주기 수소와 헬륨은 그냥 암기한다
㉡ 2주기 원소 : 족수 + 마법의 수 2
㉢ 3주기 원소 : 족수 + 마법의 수 10
㉣ 4주기 원소 : 족수 + 마법의 수 18
예) LI은 1족 2주기 원소이다
"족수 + 마법의 수"를 하면 구할 수 있다.
즉, 1족 + 마법의 수 2 = 3번이다.
S은 6족 3주기 원소이므로 6족 + 마법의 수 10 = 16번이다.
② 원자량 구하기
㉠ 짝수번호 원자량 : 원자번호 × 2
㉡ 홀수번호 원자량 : (원자번호 × 2) + 1
예) Li은 3번으로 홀수 번호이다.
(원자번호 3 × 2) + 1 = 7이 된다
S은 16으로 짝수번호이므로 원자번호 16 × 2 = 32입니다.
단, 원자량 구하기 규칙에서 예외인 원소가 몇 개 있다.
H(1), N(14), Cl(35.5), Ar(40) 4개 원소는 그냥 암기한다.
4. 주기율표를 만드는 만능 치트키 (이해가 암기를 능가한다)
이제 암기한 것을 바탕으로 한 것이 아닌 이해력을 바탕으로 한 원소주기율표를 만들어보자. 일명 원소주기율표를 만드는 치트키를 공개한다.
원소주기율표는 족과 주기로 이루어져 있다. 서두에 언급했다. 모두 기억하고 있길 바란다. 그럼 이제 아래 그림을 보자.
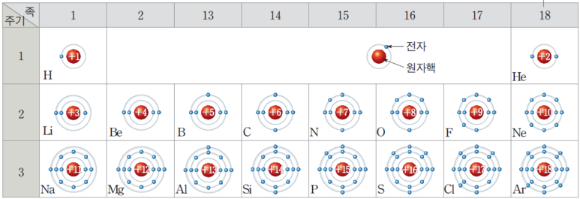
여기서는 옥텟 규칙과 오비탈 등에 대한 설명은 하지 않겠다. 설명이 복잡해지기 때문이다. 그냥 이렇구나 하고 봐주면 좋겠다. 아래는 위 그림을 조금 확대한 모습이다.
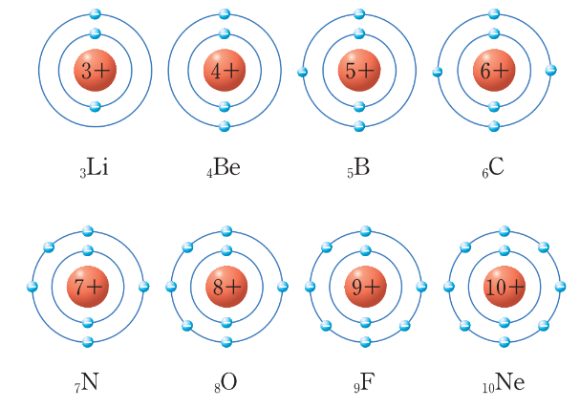
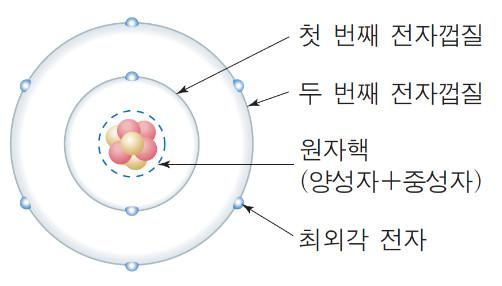
위 그림을 보면 알겠지만 원소에는 전자껍질이라는 것이 있다. 자세히 보면 원소 주위 원이 1개부터 3개까지 보인다. 이것이 전자껍질이다. 이중 가장 바깥에 있는 껍질에 있는 전자수를 최외각 전자라고 한다.
즉, 최외각 전자껍질 개수와 최외각 전자 수가 치트 키인 족과 주기를 말해주고 있다. 즉, 원자번호와 원소기호만 알면 주기율표를 만들 수 있게 되는 것이다. 여러분은 이제 주기율표를 암기할 필요 없이 만들면 되는 것이다. 지금까지 학교에서 배우지 못한, 어떤 선생님도 가르쳐 주지 않았던 내용일 것이다.
이제 이를 바탕으로 원소주기율표를 만들어 보자.
수소는 전자껍질 1개, 최외각 전자수 1개로 이루어진 원소이다.
수소는 1족 1주기이다.
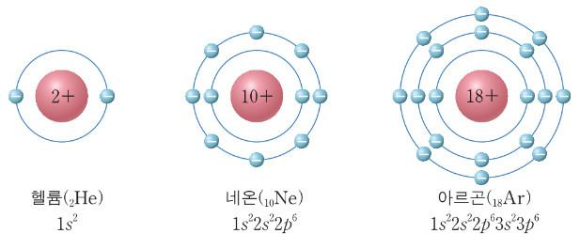
아르곤은 전자껍질 3개, 최외각 전자수 8개로 이루어진 원소이다.
전자껍질이 3개이므로 주기는 3주기라는 것을 알 수 있다. 전자수가 8개이므로 8족이라는 것을 알 수 있다.
(8족은 0족이라고도 한다.)
이번에는 질소를 알아보자.
질소는 전자껍질 2, 최외각 전자 수 5개인 원소이다.
전자껍질이 2개이므로 2주기 임을, 최외각 전자 수가 5개이므로 5족임을 알 수 있다.
여기서 마지막 치트키를 공개한다.
최외각 전자 수는 족의 화학적 성질을 결정한다.
1족은 최외각 전자 수가개이고 화학적 성질은 알칼리 금속이다.
2족은 최외각 전자 수가개이고 화학적 성질은 알칼리토 금속이다.
원소주기율표를 20개만 암기하면 위험물 기능장 자격 취득에는 큰 무리가 없다. 다만 공부하다 보면 20개 외 원소들이 나올 수 있다. 이것은 그 상황에 맞춰 암기해 두면 된다. 원소주기율표 전체를 암기해두면 아주 좋을 것이다. 하지만 시험공부는 효율이 바탕이 되어야 한다.
왜냐하면 한정된 시간에 많은 양의 공부를 해야 하기 때문이다. 버릴 것과 취할 것을 확실히 구분할 줄 아는 효율적인 공부를 해야 하는 이유다.
지금까지 일반화학으로 인해 어려움을 겪었다면 오늘 포스팅이 많은 도움이 될 것이라 확신한다.
'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 산화-환원(redox, 酸化還元), 전자의 이동, 산화수와 산화상태 (0) | 2023.11.29 |
|---|---|
| 전기음성도(전기력), 금속의 이온화 경향, 금속과 비금속의 양쪽성 원소, 암기법 (1) | 2023.11.28 |
| 이온결합 화합물 실험식(화학식) 작성 방법 (0) | 2023.11.28 |
| 이온(양이온과 음이온), 이온결합 화합물 명명법(양이온, 음이온), 다원자 이온식 및 원자가 (0) | 2023.11.26 |
| Hill system! 화학식 표기방법(실험식, 분자식) (0) | 2023.11.26 |




댓글