물질의 화학적 변화에는 반드시 화학반응이 필요하며, 이 변화를 화학적으로 기호를 사용하여 표현한 식이 화학반응식(Chemical Equation)입니다. 화학적 변화는 반응 전·후의 물질의 화학적 성질이 달라지는 것을 의미하는데 반해 물리적 변화는 화학적 성질을 그대로 유지하는 가운데 물질의 모양, 부피, 질량 등이 변화하는 것을 의미합니다.

1. 물질의 변화와 화학반응( Chemical Reactan)
1) 화학반응식을 사용하는 목적
① 반응물(Reactants; 반응 전 물질)과 생성물(Products; 반응 후 물질) 간의 반응 전후 변화 양상을 간략하게 표현합니다.
② 반응에 필요한 반응물의 소모량과 생성량과의 정확한 비례 관계(일반적으로 자연수 비)를 정량적(Quantitative)으로 표현합니다.

- 위의 반응식은
2) 화학반응에서 반응물과 생성물의 구성 원자들은 창조, 또는 소멸되지 않으므로 반응물에 존재하는 모든 원자들은 생성물에 그대로 존재하게 됩니다.
3) 화학반응식의 일반적 표현 방식
① 화살표(→)를 중심으로 좌측에 반응물(A, B,... 등), 우측에 생성물(C, D,... 등)을 화학(원소) 기호로 기재합니다.
② 각 반응물과 생성물 앞의 계수(자연수 a, b, c, d,...)는 화학반응식 사용 목적에 의거하여 반응 전·후 물질의 분해와 결합 양상에 대한 정량적 관계를 표현하고, 반응물과 생성물 앞에 계수를 써서 반응식 좌우(반응 전·후)의 단위(원자, 분자, Mole, Ion 등)의 균형을 맞추기 위해 사용(편의상 계수 “1”은 생략)합니다.


2. 화학반응의 규칙
1) 질량보존의 법칙(Law of Conservation of Mass)
화학적 변화에 관여한 물질들의 총 질량(화학반응에서 반응물의 질량은 생성물에서도 그대로 유지) 은 변하지 않습니다. 즉, 화학반응이 일어나기 전 반응물질의 총질량과 화학반응 후 생성된 물질의 총질량은 같습니다.
물을 예로 들어보면 아래 그림과 같습니다. 물을 전기분해하여 기체 상태인 수소 분자와 산소 분자로 분리하면 액체인 물은 기체로 상태가 변하게 됩니다. 이렇게 상태가 변하더라도 질량은 변하지 않는 것에 주의하시기 바랍니다. 물(

★참고 _ 무게와 질량의 차이점 : 무게는 장소에 따라 변하지만 질량은 변하지 않는다.
① 무게 : 중력이 물체를 끌어당기는 힘
② 질량 : 물체를 이루는 물질의 고유한 양
무게는 장소에 따라 변하지만 질량은 변하지 않습니다. 즉, 무게는 중력의 크기를 의미합니다.
2) 일정성분비의 법칙(Law of definite proportions (Proust's Law))
두 가지 이상의 원소가 결합하여 생성된 "하나의 화합물을 구성하는 원소들의 질량비는 항상 일정하다" 라는 법칙을 말합니다. 원자는 그 종류에 따라 일정한 질량이 있는데, 그 질량이 일정한 원자가 일정한 개수의 비율로 결합하기 때문입니다.
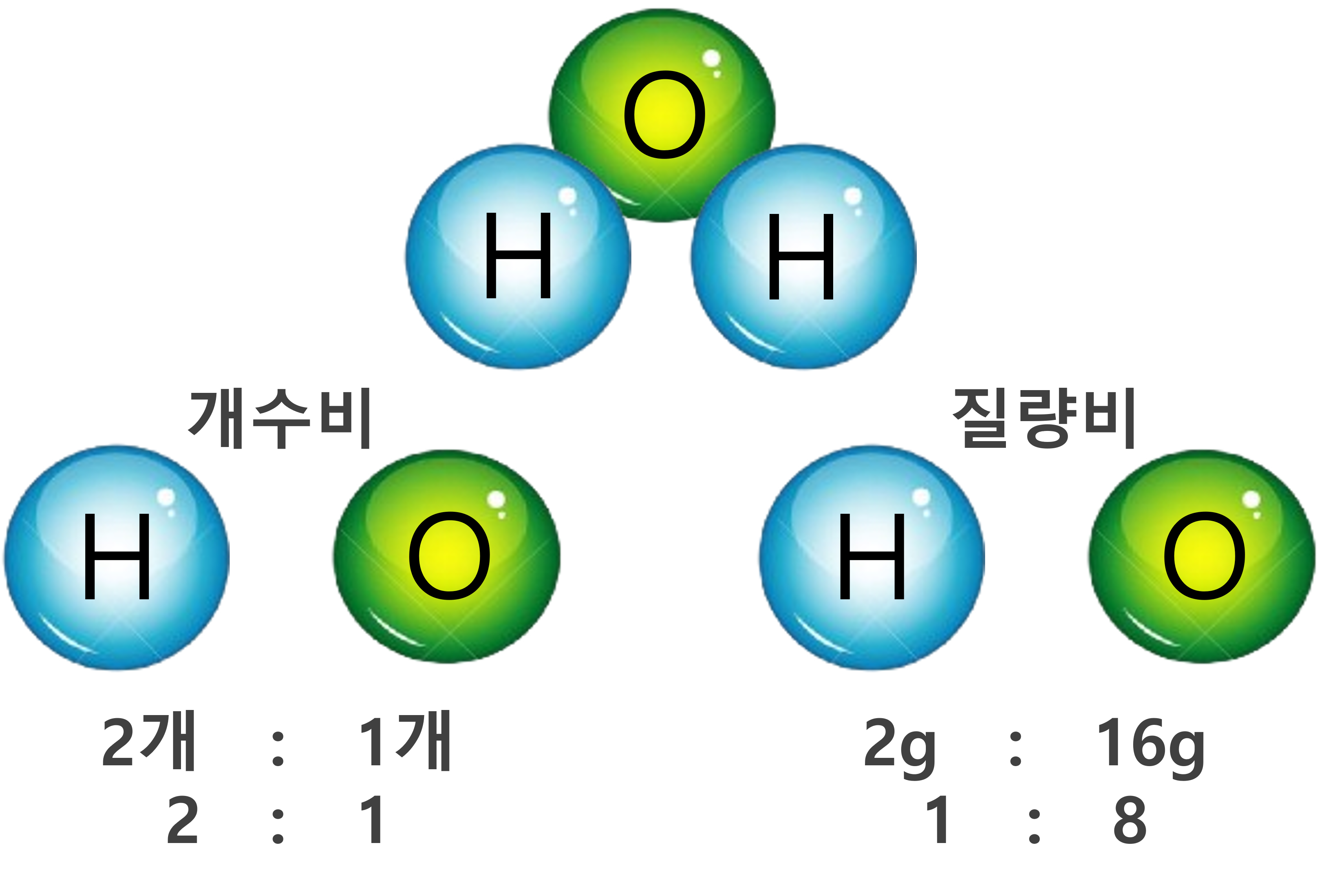
물 분자를 구성하는 수소의 질량은 1g, 산소의 질량은 16g 입니다. 위 그림과 같이 물 분자는 수소 원자 2개, 산소 원자 1개로 이루어져 있습니다. 그러므로 수소는 총 2g(1g × 2), 산소는 16g(16g × 1)의 질량이 됩니다. 즉, 2:16의 비율이 됩니다. 이것을 간단한 정수비로 나타내면 1:8의 질량비로 결합한다고 할 수 있습니다.
여기서 주위할 부분은 일정성분비의 법칙은 화합물에만 가능한 법칙이라는 것입니다. 즉, 소금물과 같은 혼합물에는 적용되지 않는 것에 주의하시기 바랍니다.
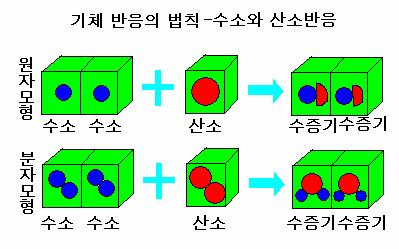
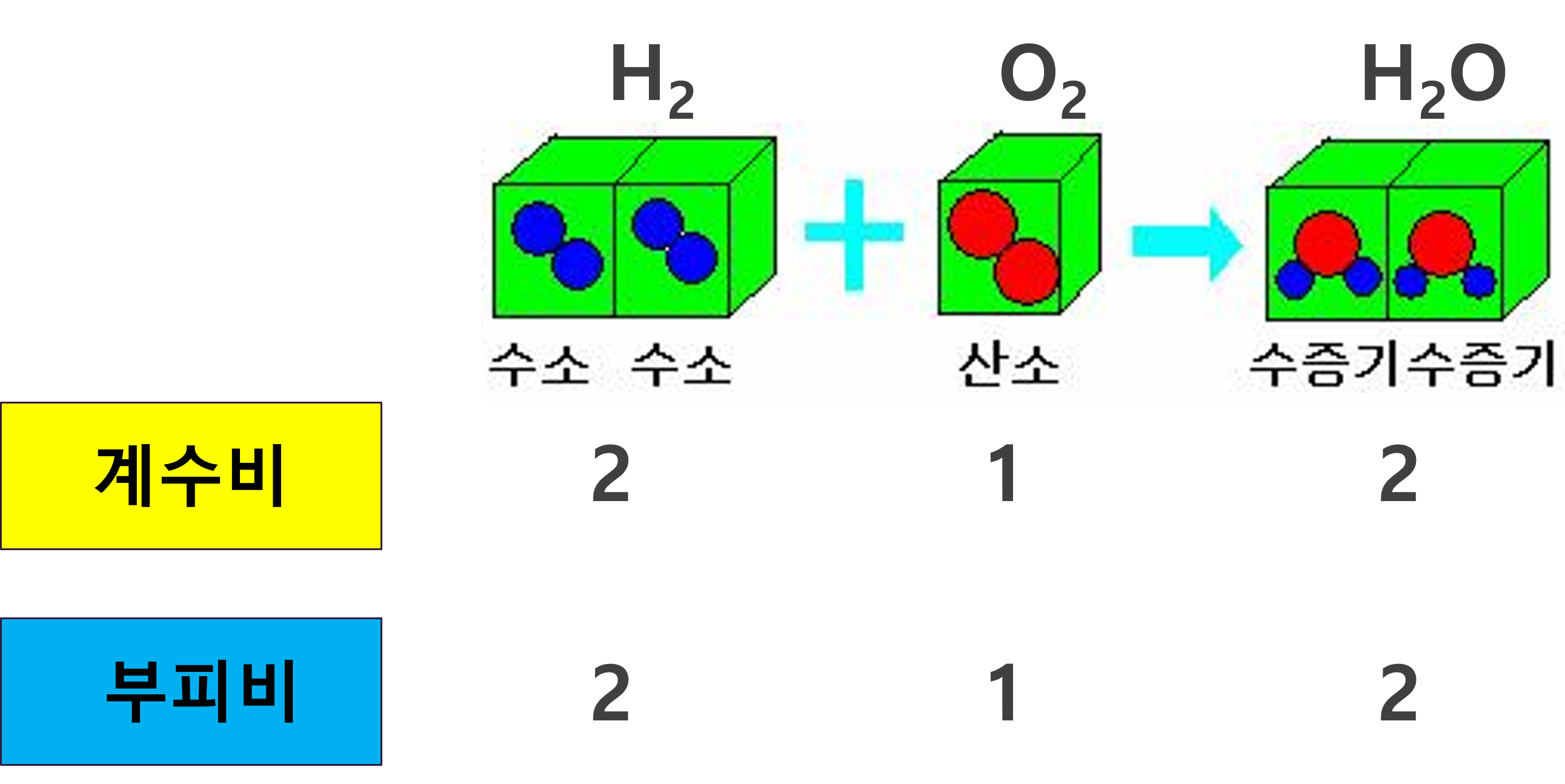
3) 기체반응의 법칙(Law of Gaseous Reaction)
반응물과 생성물이 기체일때만 성립하는 법칙입니다. "일정한 온도와 압력에서 기체들이 반응하여 새로운 기체가 형성될 때, 각 기체의 부피 사이에는 간단한 정수비가 성립한다"라는 법칙을 말합니다.
기체 분자들은 종류나 그 크기에 상관없이 일정한 온도와 압력이라는 조건 아래 분자 한 개가 차지하는 부피는 모두 같습니다. 따라서 기체의 부피비는 분자 수의 비와 같고, 분자 수의 비는 화학반응식의 계수비와 같습니다.
3. 화학반응식을 통해 알 수 있는 것
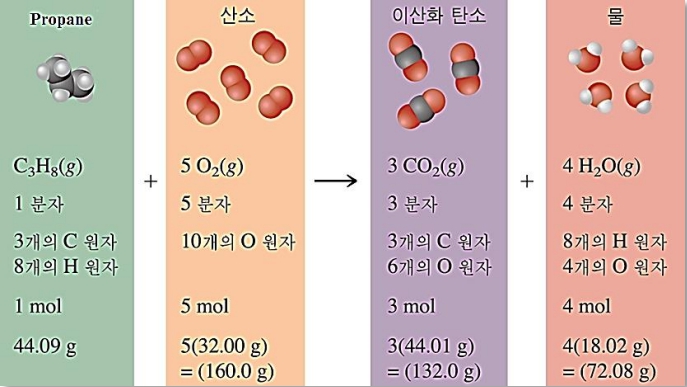
1) 화학 반응식이 알려 주는 반응에 대한 정보
① 반응물(Reactants)과 생성물(Products)
② 반응물과 생성물의 화학식
③ 반응물과 생성물의 분자 수와 화학식 단위 수
④ 반응에 관여하는 각 원소의 원자 수
⑤ 각 물질의 Mole 수(mol)
⑥ 그 외 반응물, 생성물의 상태(상) 반응 조건(가열), 생성물 형성 시의 발열(Exothermic Reaction), 또는 흡열(Endothermic Reaction) 등 정보
2) 화학식은 1개의 화학적 개체(원자, Ion, 분자, 화학식 단위)를 나타낼 수도 있고 1 mol을 나타낼 수 도 있다
3) 화학식 단위 H2OH2O
① 2개의 H원자와 1개의 O 원자
② 1개의 물 분자
③ 1 mol의 물
④ 6.022 x
⑤ 18.02g의 물

4. 화학반응식 쓰기와 균형 맞추기
1) 반응식의 좌우(반응 전·후) 균형 맞추기
반응의 정량적 관계를 표현하기 위해 화학반응식의 좌·우의 균형을 확보합니다. 즉, 식의 양측에 있는 각 원소의 원자 수가 동일하고, 질량보존의 법칙을 만족하도록 해야 합니다.
- 예제 : 산화수은(II)이 가열, 분해되어 수은과 산소를 생성
① 반응 확인
주어진 정보에 의해 반응의 내용 확인, 균형이 맞지 않는 채로 반응식(골격 반응식 ; Skeleton Equation)을 표기하고, 각 원자·분자 또는 화합물의 화학식의 적정성 여부, 반응물과 생성물의 위치(좌·우)를 확인합니다.
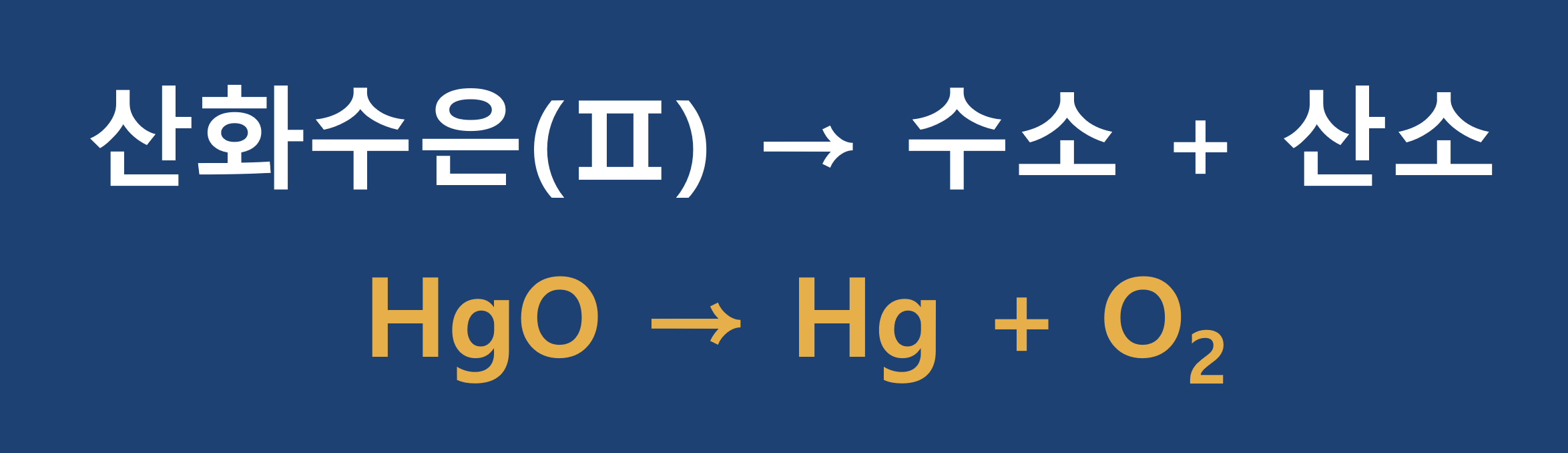
2) 물질의 계수 조정으로 반응식의 좌우 균형 맞추기
① 좌우 각 원소의 원자 수 비교, 균형이 맞지 않는 원소 확인합니다.
- Hg : 균형 (좌/우 = 1:1), O : 불균형 (좌/우 = 1:2)
② 균형이 맞지 않는 원소를 포함하는 원자, 분자, 또는 화합물의 화학식 앞에 계수를 써서 각 원소 별로 한 번에 하나씩 균형을 맞추어 줍니다. (일반적으로는 금속, 비금속, 수소, 산소 순으로 맞추어주는 것이 요령입니다.)
좌·우 양측 원소의 원자 수가 동일하도록 가장 작은 계수를 선정합니다. 위 예에서는

③ 다른 원소의 균형이 맞는지 확인합니다.
- 특정 원소의 균형을 맞출 때 다른 원소의 균형이 깨질 수 있기 때문입니다. 위의 예에서

이렇게 하여 화학반응식이 완성되었습니다. 화살표 좌측 반응물의 산화수은(Ⅱ)에서 수소 2개, 산소 2개, 화살표 우측 생성물에 수은 2개, 산소 2개로 좌·우 균형이 맞게 되었습니다.
④ 각 원소나 다원자 Ion의 균형이 맞는지, 가장 작은 계수가 사용되었는지 최종 검토를 하고 화학반응식을 완성합니다.
5. 화학 반응식 쓰기와 균형 맞추기 연습문제
1) MgMg MgOMgO
① 문제를 토대로 골격 반응식을 만듭니다.
- 문자로 된 반응식을 계수가 맞추어지지 않은 형태인 골격 반응식으로 표현합니다.
② 좌우 균형(계수) 맞추기
㉠ 좌우 각 원소의 원자 수 비교하여 균형이 맞지 않는 원소를 확인합니다.
-
③ 균형이 맞지 않는 원소를 포함하는 원자, 분자, 화합물의 화학식 앞에 계수를 써서 각 원소 별로 한 번에 하나씩 균형을 맞추어 줍니다.
- 좌우 양측 원소의 원자 수가 동일하도록 가장 작은 계수를 선정합니다. 위의 예에서는 산소의 균형을 맞추기 위해 우측
④ 다른 원소의 균형이 맞는지 확인합니다.
– 좌측의
⑤ 각 원소와 화합물의 좌·우의 균형이 맞는지, 가장 작은 계수가 사용되었는지 최종 검토 후 화학반응식을 완성합니다.
2) CH4CH4 O2O2 CO2CO2 H2OH2O
① 문제풀이를 빠르고 쉽게 할 수 있도록 연습이 필요합니다. 앞에서 언급한 각 단계별로 해도 되지만 시험장에서는 시간이 촉박하므로 화학 반응식을 빠르게 작성할 수 있도록 연습을 해두시기 바랍니다.
② 이 문제는
| 화학 반응식 | 반응물 | 생성물 | ||||
| 1C | 4H | 2O | 1C | 2H | 3O | |
| ① 위와 같이 계수가 맞추어지지 않은 골격식을 만들고 좌우 각 원소의 원자 수 비교하여 균형이 맞지 않는 원소를 확인합니다. | ||||||
| 1C | 4H | 2O | 1C | 4H | 4O | |
| ② 좌측의 |
||||||
| 1C | 4H | 4O | 1C | 4H | 4O | |
| ③ 마지막으로 우측에는 산소가 4개인데 좌측에는 2개이므로 계수 2를 입력하여 4개로 균형을 맞추어 줍니다. |
||||||
3)
- 식을 여러 번 쓰지 않고 더 간단하게는 만드는 훈련이 필요합니다.
| 화학 반응식 | 반응물 | 생성물 | ||||
| 1K | 1Cl | 3O | 1K | 1Cl | 2O | |
| ① 계수가 맞추어지지 않은 골격 반응식을 쓰고 좌우 원자 수 비교하여 균형이 맞지 않는 원소를 확인합니다. | ||||||
| 2K | 2Cl | 6O | 1K | 1Cl | 6O | |
| ② 좌우 계수를 맞추기 위해 2와 3의 최소공배수 6을 이용하여 산소의 계수를 맞추어 줍니다. | ||||||
| 2K | 2Cl | 6O | 2K | 2Cl | 6O | |
| ③ K, Cl 계수를 맞춥니다. 좌변에 각 2개씩이므로 우변에 계수 2를 입력하여 맞추어 줍니다. | ||||||
4)
① 이 문제는 4개의 원소가 개입된 경우의 균형(계수) 맞추기 임에 주의하세요.
② 간략한 방법으로 계수를 맞추되 4 종 원소의 반응 전후 계수를 맞추어 주어야 합니다. 또한 질산기(
③ 이 부분의 문제를 이해하고 풀기 위해서는 다원자 이온식 및 원자가에 대한 선행 학습이 필요합니다. 안되어 있다면 위에서 링크를 참조하세요.
| 화학 반응식 | 반응물 | 생성물 | ||||||
| ① 계수가 맞추어지지 않은 골격 반응식을 쓰고 좌우 원자 수 비교하여 균형이 맞지 않는 원소를 확인합니다. | ||||||||
| ② Ag의 계수를 맞추기 위해 좌측에 2를 입력하고, 좌우의 계수 변화를 비교합니다. | ||||||||
| ③ H의 계수를 맞추기 위해 우측에 계수 2를 입력하여 맞추어 줍니다. 좌우 계수를 비교하여 식을 완성합니다. | ||||||||
4) 부탄이 완전연소하는 화학반응식을 쓰시오.
① 완전연소 반응식(골격 반응식)을 작성합니다. ( □에 계수를 넣어 완성하면 됩니다.)
□
② 탄화수소 화합물이 완전연소하기 위해서는
| 화학 반응식 | 반응물 | 생성물 | ||||
| 4C | 10H | 2O | 1C | 2H | 3O | |
| ① 골격식을 쓰고, 좌·우 균형을 비교합니다. | ||||||
| 4C | 10H | 2O | 4C | 2H | 9O | |
| ② 익힌 순서에 따라 C의 계수부터 맞춥니다. 좌측에 4개 이므로 우측에도 4개를 넣어줍니다. | ||||||
| 4C | 10H | 2O | 4C | 10H | 13O | |
| ③ 익힌 순서에 따라 H의 계수를 맞춥니다. 좌측에 10개이므로 우측에도 10개를 맞춥니다. ④ 다음으로 산소의 계수를 맞춥니다. 그런데 문제가 있습니다. 좌측은 2개, 우측은 13개로 2와 13의 최소공배수가 필요하므로 좌·우 모두 계수 조정을 해주어야 합니다. |
||||||
| 8C | 20H | 26O | 8C | 20H | 26O | |
| ⑤ 최소공배수 26을 얻기 위해 우측 ⑥ 우측에 H가 20개 이므로 좌측에도 20개를 맞추기 위해 |
||||||
★참고 _ 탄화수소화합물의 완전연소 반응식의 공식
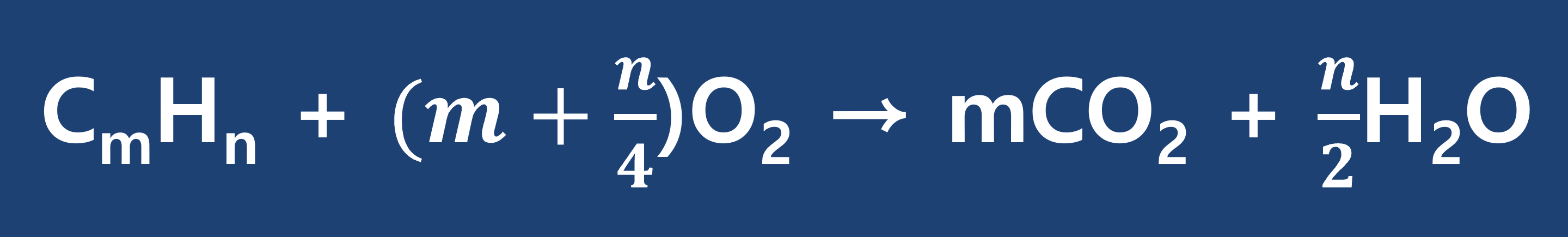
6. 화학반응식을 만들기 위해 참고하면 좋을 내용
1) Hill system! 화학식 표기방법(실험식, 분자식)
2) 이온(양이온과 음이온), 다원자 이온식 및 원자가
3) 이온결합 화합물 실험식(화학식) 작성 방법
4) 전기음성도(전기력), 금속의 이온화 경향, 금속과 비금속의 양쪽성 원소
5) 산화-환원(redox), 전자의 이동, 산화수와 산화상태
6) 산화수를 구하는 규칙과 산화수 계산 방법
7) 물질, 원소, 원자, 분자, 화합물, 화학식(분자식, 실험식, 구조식)
8) 화학식(분자식, 실험식, 시성식, 구조식, 이온식), 화학식과 분자식의 차이점
9) 화학식(분자식)을 만드는 규칙(방법)
10) 화학반응의 종류 8가지
11) 산화-환원 반응(산화제와 환원제)
12) 산화·환원 반응, 산성 용액과 염기성 용액에서 균형 맞추기
13) 산화·환원 반응 균형 맞추기, 반쪽 반응법, 이온 전자법
14) 원소주기율표 만들기 치트키와 암기법
위험물기능사, 위험물산업기사, 위험물기능장 자격증 취득을 원하신다면 일반화학은 반드시 정복을 해야 합니다. 그렇다고 모든 내용을 공부해야 할 필요성은 없습니다. 제가 설명드린 내용만 공부하면 시험 합격하는 데는 아무런 문제가 없습니다.
내용이 많아 보여도 일반화학에 나오는 내용의 1/10도 되지 않습니다. 이것만 공부하면 화학이 즐거워질 것입니다. 여러분의 자격증 취득을 기원합니다. 늘 감사합니다.
'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 알짜 이온 반응식 쓰고 구경꾼 이온 찾기 (0) | 2023.12.14 |
|---|---|
| 분자 반응식 작성하기, 분자 반응식 쓰기, 분자 반응식 만들기 (0) | 2023.12.12 |
| 산화·환원 반응 균형 맞추기(완성하기), 반쪽 반응법(산성 용액에서, 염기성 용액에서), 이온 전자법 (0) | 2023.12.09 |
| 산화·환원 반응, 산성 용액과 염기성 용액에서 균형 맞추기 (1) | 2023.12.08 |
| 산화-환원 반응(산화제와 환원제) (0) | 2023.12.06 |




댓글