안녕하세요. 여러분의 자격시험(위험물 기능장) 합격을 위해 노력하는 더불어숲입니다. 이번 시간에는 기체 법칙의 보일의 법칙, 샤를의 법칙, 보일-샤를의 법칙에 대해 말씀드리겠습니다. 보일의 법칙은 기체의 압력과 부피가 반비례한다는 법칙입니다(

같이 보면 좋을 내용 _ 아보가드로의 법칙, 기체의 양과 부피 관계 설명
보일의 법칙
보일의 법칙은 기체의 압력과 부피 사이에 반비례 관계가 있다는 법칙입니다. 이 법칙은 온도와 기체의 양이 일정한 닫힌 계 내에서 일정한 질량의 이상 기체가 가하는 절대압력이 그것이 차지하고 있는 부피에 반비례한다는 것을 의미합니다. 보일의 법칙은 다음과 같이 표현될 수 있습니다.
여기서
▶ 일정한 온도에서 일정량의 기체의 부피는 그 기체의 압력에 반비례한다.

▶ 연습문제
압력이 740mmhg에서 320㎖를 차지하는 기체에 온도를 일정하게 하고, 압력을 640mmhg로 하면, 그 부피는 얼마인가?
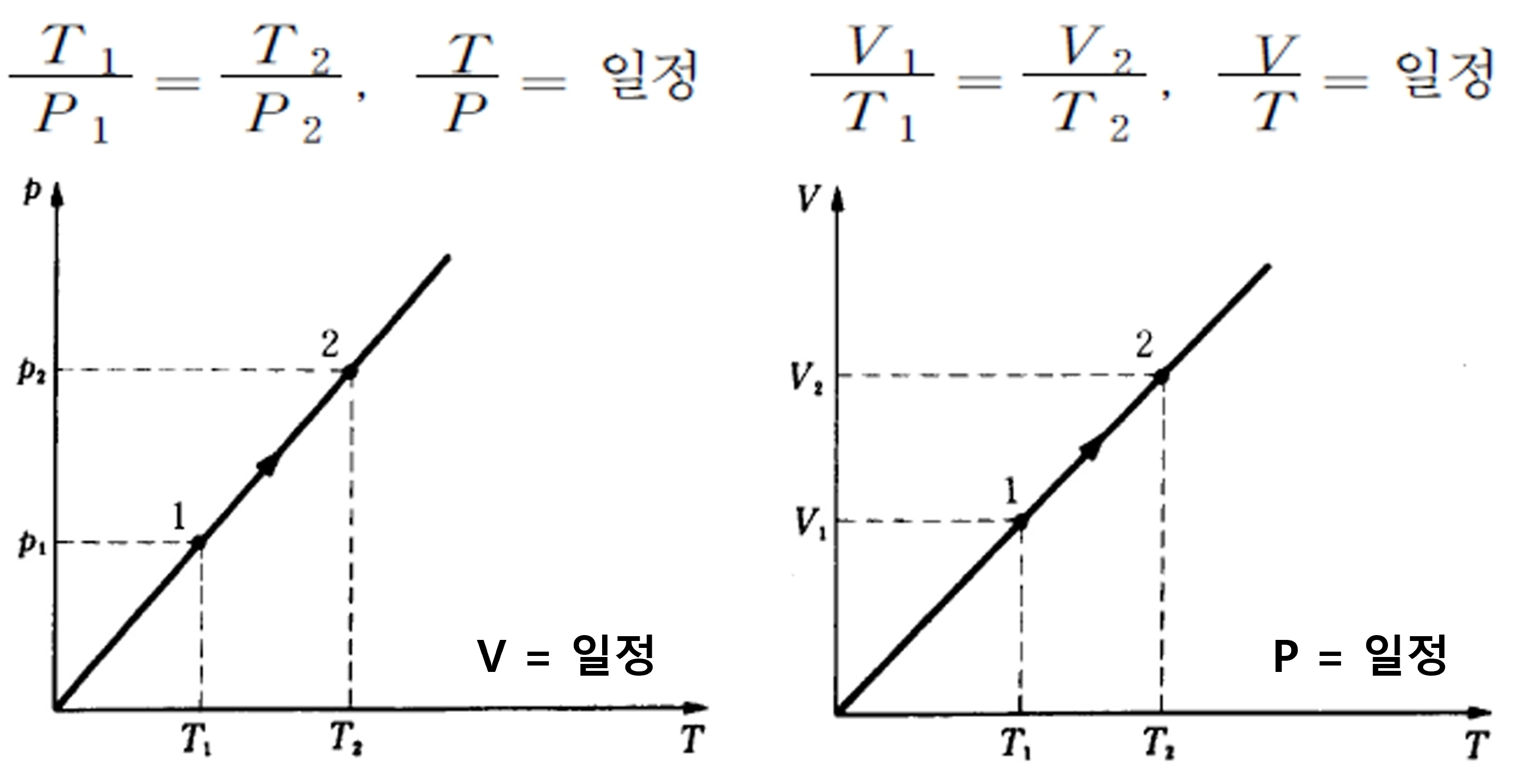
샤를의 법칙
샤를의 법칙은 기체의 부피와 온도 사이에 정비례 관계가 있다는 법칙입니다. 이 법칙은 압력이 일정할 때 기체의 온도가 높아지면 기체의 부피가 증가하고, 온도가 낮아지면 부피가 감소한다는 것을 의미합니다. 수학적으로 샤를의 법칙은 다음과 같이 표현될 수 있습니다.
여기서

▶ 압력이 일정할 때 일정량의 기체의 부피는 1℃ 상승함에 따라 0℃때의 부피의
▶ 연습문제
18℃, 760mmhg에서 170㎖의 공기는 0℃ 1 기압에서 그 부피가 몇 ㎖인가?
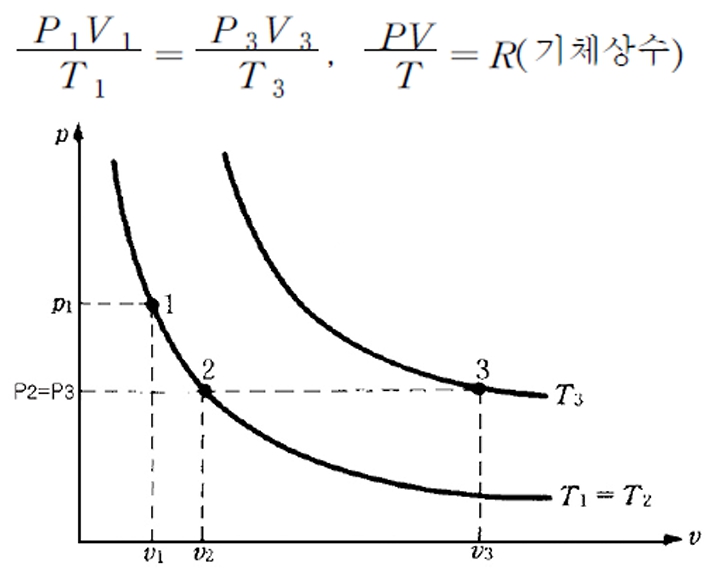
보일-샤를의 법칙
보일-샤를의 법칙은 기체의 압력, 온도, 부피 사이의 관계를 나타내는 기체 법칙으로, 보일의 법칙과 샤를의 법칙을 종합한 것입니다. 이 법칙과 아보가드로의 법칙을 종합하면 이상기체 상태방정식이 나옵니다. 이상기체 상태방정식은 다음과 같습니다:
여기서
▶ 일정량의 기체의 부피가 차지하는 부피는 절대온도에 비례하고 압력에 반비례한다
▶ 연습문제
0℃ 1 기압에서 10 ℓ 인 기체가 있다. 273℃ 4 기압에서 기체가 차지하는 부피는 몇 ℓ 인가?
오늘 배운 내용을 다시 한번 정리 후 마무리 하도록 하겠습니다. 보일의 법칙, 샤를의 법칙, 그리고 보일-샤를의 법칙은 기체의 특성을 설명하는 중요한 원리들입니다.
1. 보일의 법칙
이 법칙은 기체의 압력과 부피 사이에 반비례 관계가 있다는 것을 나타냅니다. 즉, 온도와 기체의 양이 일정한 닫힌 계 내에서 일정한 질량의 이상 기체가 가하는 절대압력은 그것이 차지하고 있는 부피에 반비례한다는 것입니다.
2. 샤를의 법칙
이 법칙은 기체의 부피와 온도 사이에 정비례 관계가 있다는 것을 나타냅니다. 즉, 압력이 일정할 때 기체의 온도가 높아지면 기체의 부피가 증가하고, 온도가 낮아지면 부피가 감소한다는 것입니다.
3. 보일-샤를의 법칙
이 법칙은 기체의 압력, 온도, 부피 사이의 관계를 나타내는 기체 법칙으로, 보일의 법칙과 샤를의 법칙을 종합한 것입니다. 이 법칙과 아보가드로의 법칙을 종합하면 이상기체 상태방정식이 나옵니다.
이러한 법칙들은 기체의 특성을 이해하고 예측하는 데 매우 중요하며, 열역학, 화학, 물리학 등 다양한 과학 분야에서 활용됩니다. 그러므로 반드시 이해하고 있어야 할 내용입니다. 다음 시간에는 기체 법칙의 완성인 이상기체 상태방정식으로 뵙겠습니다.
지금까지 여러분의 합격을 진심으로 원하는 더불어숲이었습니다. 감사합니다.
'위험물 기능장 > 일반화학' 카테고리의 다른 글
| 위험물 기능장 합격을 위한 문제로 익히는 이상기체 상태 방정식 ① (1) | 2024.02.20 |
|---|---|
| 위험물 기능장 취득을 위한 기체 법칙 중 이상기체 상태 방정식 완벽 정리 (0) | 2024.02.19 |
| 아보가드로의 법칙(Avogadro's law), 기체의 양과 부피 관계 설명 (1) | 2024.02.16 |
| 위험물 기능장 취득을 위한 유체역학 중 밀도(ρ), 비중(S), 비중량(γ) 간단 정리 (1) | 2024.02.14 |
| 몰농도와 퍼센트 농도의 개념과 문제풀이(위험물기능장 시험 대비) (0) | 2024.02.07 |




댓글